主动脉夹层并发肝素诱导性血小板减少症一例诊疗

冯蕊,硕士研究生在读,研究方向:心血管生物标志物的临床应用,在《Frontiers in Oncology》杂志发表论文1篇。

范庆坤,主任技师, 武汉科技大学医学院副教授,心肌病遗传咨询师,中国合格评定国家认可委员会(CNAS)医学实验室评审员,主要研究方向:心血管疾病的多学科联合早期筛查和治疗监测。重点关注疾病为肝素诱导血小板减少症和心脏淀粉样变。
肝素诱导血小板减少症(heparin-induced thrombocytopenia,HIT)是肝素导致的严重不良反应,由致病性IgG抗体(HIT抗体)介导的血栓性疾病[1, 2]。临床表现为血小板计数减少和血栓形成。一旦诊断或识别错误,将导致患者致残,严重时可致命[3]。接受心脏外科手术的患者因术中使用体外循环辅助而使用大量肝素抗凝,比内科患者更易产生HIT抗体[4]。因此,早期识别HIT并有效干预尤为重要。然而,当有HIT既往史的患者面对无法避免的肝素再暴露时如何处理也是临床医生面临的棘手问题。现将1例主动脉夹层患者二次手术后再次发生HIT的病例,以提高对这一突发灾难性血栓并发症疾病的认识及处理能力。
一、临床资料
1.一般资料:患者男,63岁。因“大血管术后8个月,间断腹痛、背痛3天”于2022年8月18日收入武汉亚洲心脏病医院心外科。
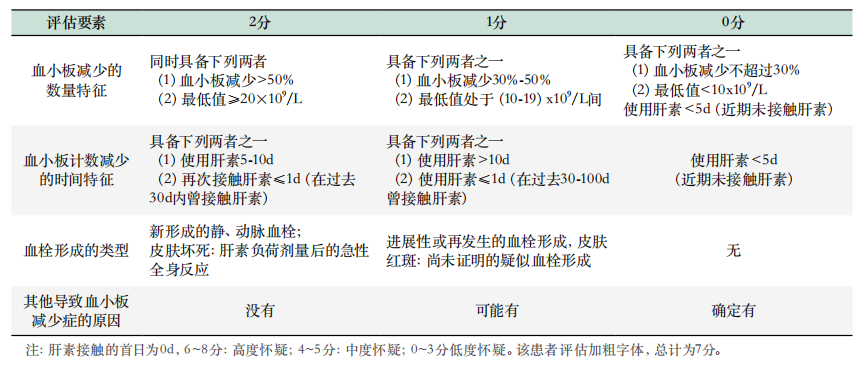
2. 现病史:在8月前患者因“突发胸背部疼痛7小时”在我院诊断为A型主动脉夹层,诊断明确,有外科手术指征,于2021年12月22日急诊行窦部成形术、升主动脉部分切除伴人工血管置换术、全主动脉弓人工血管置换术、象鼻支架置入、心表临时起搏器安置术,术后当抗凝治疗。术后第6天起,血小板逐渐回升。患者一般状态尚可,复查无特殊异常后出院。转天因室速、室颤,行冠状动脉旁路移植术。手术日血小板计数为81×109/L,术后第5天降至46×109/L,呈进行性下降。4T风险评分(表1)为7分, 肝素-血小板因子4复合物(PF4-H)抗体检测1.30U/mL(正常参考区间:0-1.0U/mL),考虑HIT,暂停肝素抗凝,改用阿加曲班外规律口服拜阿司匹林、华法林、琥珀酸美托洛尔缓释片、立普妥及营养神经药物。2022年8月15日23点左右无明显诱因突发上腹痛及背痛不适,为胀痛,无出汗、乏力,无咳嗽、咳痰,无胸痛等,至次日凌晨1点左右症状缓解,外院行胸+腹主动脉CTA提示新发夹层,遂以“主动脉夹层B型、血管置换术后状态、冠状动脉粥样硬化性心脏病、冠状动脉搭桥术后、高血压2级”再次收入我院治疗。既往有高血压病史10余年。
3. 身体检查:体温:36.8℃,心率:74次/分,呼吸:17次/分,血压:111/55mmHg,血氧饱和度:100%,律齐,心音略低,胸部可见陈旧性手术疤痕长约18cm,双肺呼吸音稍粗,未闻及明显干、湿啰音,腹部平软,肝、脾肋下未触及,双下肢无水肿。
4. 实验室检查:首次(图1)及二次入院(图2)血小板计数、D-二聚体及PF4-H抗体动态变化。
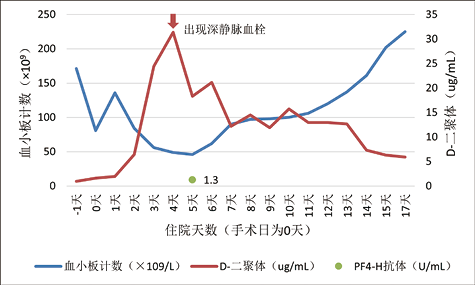
图1. 首次入院血小板计数、D-二聚体及PF4-H抗体动态变化
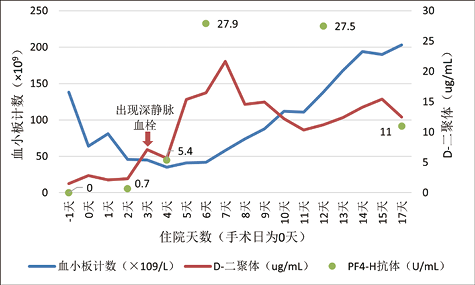
图2. 两次入院血小板计数、D-二聚体及PF4-H抗体动态变化
表1. HIT诊断相关的4T评分
二、诊断与鉴别诊断
1. 目前诊断:(1)主动脉夹层B型 血管置换术后状态;(2)冠状动脉粥样硬化性心脏病 冠状动脉搭桥术后;(3)高血压2级;(4)HIT。
2. HIT鉴别诊断:(1)血栓性血小板减少性紫癜(TTP):是一种累及全身多器官系统的微血管血栓出血综合征,主要临床表现有以皮肤、黏膜出血为主(主要鉴别点,HIT出血少见),严重者颅内出血。(2)免疫性血小板减少性紫癜(ITP):与HIT主要鉴别点是,ITP患者出血程度与血小板计数相关,大约50×109/L时常为损伤后出血,(20~50)×109/L之间可有不同程度自发性出血,<20×109/L时常有严重出血。(3)药物、感染等所致的血小板减少:药物性因素导致的血小板减少多与药物抑制骨髓血小板生成、药物性抗体介导血小板免疫性破坏有关,严重者可引起皮肤紫癫,多数患者停药后血小板计数可恢复。感染性因素导致的血小板减少多与病原体抑制骨髓增殖或免疫复合物介导血小板破坏有关,患者往往合并多种病因,严重者皮肤出现大片触痛性瘀斑,伴出血性大瘤和坏死[2]。(4)机械损伤:机械辅助装置可引起血小板机械损伤,例如IABP球囊导管扩张时会受到动脉内膜的挤压,引起血小板水平的减少,但血小板计数一般>50×109/L,多发生在术后1-2天,此后恢复基线水平。
三、临床治疗
入院后于2022年8月25日在全麻下行Redo-胸腹主动脉管置换术(手术用时8时29分,术中辅助循环258分钟),术后转入ICU,给予呼吸机辅助,维护心功能、扩管、调整血容量、调整凝血功能、稳定内环境、预防感染及对症支持等治疗,术后顺利脱机拔管。术后患者血小板减少,维持在(40-50)×109/L,考虑血小板减少原因可能有感染、手术因素和肝素等,且该患者有肝素接触史,临床进行4T评分评估为4分,属HIT中度概率。进一步送检PF4-H抗体,结果阴性,目前HIT可能性小,于术后第1天、第2天及第4天分别输注血小板1人份,复查血小板计数短暂上升后再次下降。鉴于患者D-二聚体浓度较前一天显著增高并有HIT既往史,提示血栓高危状态,送检PF4-H抗体结果为5.4U/mL,立即停用肝素类抗凝药,启动低剂量起始替代抗凝。术后第6天患者出现间断谵妄状态,查体见右侧腹股沟区、大腿内侧、阴囊可见大面积青紫,床旁超声检查:右侧颈内静脉血栓,双侧小腿肌间静脉血栓形成,右侧腓静脉、局部胫后静脉血栓形成。临床及时增加阿加曲班用药剂量,血小板计数稳步提升。术后第9天开始华法林重叠用药,重叠3天后阿加曲班停用,华法林持续服药。
四、治疗结果、随访及转归
患者病情逐渐稳定后于术后第13天转入术后病房继续治疗,术后第15天胸腔引流减少后拔除引流管,术后第18天复查血小板已恢复正常水平,复查心脏彩超及大血管增强CT提示人工管腔显影好,人工管道血流通畅,近期出院。1个月后随访,患者病情平稳,无新发血栓事件。
五、讨论与分析
HIT是一种肝素副作用,一般在肝素应用后5-14天出现血小板计数下降幅度>30%。对于有HIT抗体的患者若在100天内再次发生肝素暴露,可在24小时内出现速发型HIT,而迟发型是肝素暴露30天后发生HIT[2, 5]。HIT的发病率取决于临床情况(外科>内科,心脏外科手术患者绝对数量最大)、肝素的类型(普通肝素>低分子量肝素)和剂量(治疗量>预防量)[6, 7]。本例患者为老年男性,手术复杂且体外循环时间长,术中普通肝素长时间暴露,显然增加了患HIT的风险。
在4T评分和血小板数量动态监测基础上,联合HIT抗体检测或血小板功能试验进行排除诊断和确诊[2]。对4T评分中有中、高可能性的患者进行HIT抗体检测(具体赋分见表1)[5]。其中HIT混合抗体(IgG/IgM/IgA)检测又称“功能性筛查试验”。这与HIT确诊试验“SRA”检测相关性好[8, 9]。本例患者术后血小板先升高后降低,呈现双相模式(图2), 被认为与HIT的发生密切相关[10, 11]。此外D-二聚体显著上升(图2),超声提示多处静脉血栓形成,4T评分7分,符合HIT高风险患者的特征,且有PF4-H抗体阳性,可确诊为HIT。
HIT患者出血不常见,主要以血栓高风险为主。如评估目前暂无任何出血症状或血小板计数>15×109/L时,不建议输注血小板制剂。当患者被高度疑似或确诊为HIT患者,立即停止接触任何肝素及其类似物抗凝剂,同时开始非肝素抗凝剂治疗(如阿加曲班、磺达肝葵钠和比伐芦定等)[12, 13]。本例患者术后接受血小板输注治疗后血小板计数未见明显上升。当临床停止使用肝素改用阿加曲班抗凝的7天后,血小板缓慢回升至111×109/L。阿加曲班由肝脏清除,当肝功能正常时,半衰期为40min;肝功能损伤时,半衰期可延长至180min,启始剂量为2mcg/kg/min,最大剂量不超过10mcg/kg/min[2, 7]。血小板计数恢复至100×109/L或持续上升幅度≥50%,可启动桥接华法林。因华法林使用的前3天可能由于蛋白C活性降低导致高凝状态,本例患者华法林与阿加曲班重叠5天,从第3天起逐渐调低阿加曲班剂量。
对于既往诊断HIT患者,术前应进行HIT抗体筛查,评估患者体内是否仍然存在HIT抗体。急性HIT的患者,尽可能推迟手术时机,待HIT抗体阴性(100天左右)时进行心脏手术,术中采用肝素抗凝,术前及术后建议使用非肝素类抗凝药物。术后5-10天可能会再发HIT,需密切观察血小板计数情况。而需紧急手术的HIT抗体阳性患者,建议将比伐芦定作为术中抗凝药[2, 14]。本例患者二次手术时间距离首次手术发生HIT间隔8个月,术前PF4-H抗体检测阴性,血小板计数正常,术中肝素暴露4天后PF4-H抗体浓度明显增强,抗体产生提前,血栓事件发生时间较首次提前。同样Warkentin和Sheppard等发现,17名有HIT病史的患者在HIT诊断后8周到13.5年期间接受了心脏或血管手术,术中均有肝素暴露,术后约有47%的患者HIT抗体阳性和血清素释放试验(SRA)阳性,具有较高的阳性转换率[15, 16]。
综上所述, HIT的早期诊断和治疗是预防严重并发症的关键,当发生HIT时,首要的治疗是停止接触所有肝素类制剂, 启用替代非肝素抗凝。而肝素作为心脏外科手术的重要治疗药物,在HIT患者的术后抗凝过程中应避免使用,防止血栓栓塞性疾病发生。
参考文献
Mongirdienė A, Liuizė A, Kašauskas A. Novel Knowledge about Molecular Mechanisms of Heparin-Induced Thrombocytopenia Type Ii and Treatment Targets [J]. Int J Mol Sci, 2023, 24(9): 8217.
中国医师协会心血管内科医师分会血栓防治专业委员会, 《中华医学杂志》编辑委员会. 肝素诱导的血小板减少症中国专家共识(2017) [J]. 中华医学杂志, 2018, 98: 408-417.
Gruel Y, De Maistre E, Pouplard C, et al. Diagnosis and Management of Heparin-Induced Thrombocytopenia [J]. Anaesth Crit Care Pain Med, 2020, 39(2): 291-310.
Warkentin TE, Sheppard JI, Whitlock RP. Temporal Presentations of Heparin-Induced Thrombocytopenia Following Cardiac Surgery: A Single-Center, Retrospective Cohort Study [J]. J Thromb Haemost, 2022, 20(11): 2601-2616.
Koster A, Nagler M, Erdoes G, et al. Heparin-Induced Thrombocytopenia: Perioperative Diagnosis and Management [J]. Anesthesiology, 2022, 136(2): 336-344.
Revelly E, Scala E, Rosner L, et al. How to Solve the Conundrum of Heparin-Induced Thrombocytopenia During Cardiopulmonary Bypass [J]. J Clin Med, 2023, 12(3): 786.
范庆坤, 张真路. 如何面对肝素诱导血小板减少症诊断的困惑 [J]. 中华检验医学杂志, 2019, 42: 227-231.
任静, 张珠博, 门剑龙, 等. 三种肝素诱导的血小板减少症抗体检测的诊断性能研究 [J]. 中华检验医学杂志, 2019, 42: 848-852.
范庆坤, 杜佳, 李玲, 等. Hit-Ab检测对肝素诱导血小板减少症新发血栓的预测价值 [J]. 中华检验医学杂志, 2019, 42: 250-254.
Lillo-Le Louët A, Boutouyrie P, Alhenc-Gelas M, et al. Diagnostic Score for Heparin-Induced Thrombocytopenia after Cardiopulmonary Bypass [J]. J Thromb Haemost, 2004, 2(11): 1882-1888.
Solanki J, Shenoy S, Downs E, et al. Heparin-Induced Thrombocytopenia and Cardiac Surgery [J]. Seminars in Thoracic and Cardiovascular Surgery, 2019, 31(3): 335-344.
孔杰, 刘正立, 赵伯翔,等. 阿加曲班抗凝治疗下肢深静脉血栓对预防ⅱ型肝素诱导的血小板减少症的疗效 [J]. 中国临床研究, 2022, 35(10): 1382-1385.
李哲, 管玉龙, 黑飞龙. 肝素诱导血小板减少症患者体外循环及体外膜氧合中的抗凝处理 [J]. 中国体外循环杂志, 2023, 21(2): 119-123.
Pishko AM, Cuker A. Heparin-Induced Thrombocytopenia and Cardiovascular Surgery [J]. Hematology, 2021, 2021(1): 536-544.
Warkentin TE. Acute Intraoperative Hit During Heart Surgery: Why So Rare? [J]. Thrombosis Research, 2016, 146: 110-112.
Warkentin TE, Sheppard JA. Serological Investigation of Patients with a Previous History of Heparin-Induced Thrombocytopenia Who Are Reexposed to Heparin [J]. Blood, 2014, 123(16): 2485-2493.




