利奈唑胺致血小板减少症1例临床诊疗分析

陶翠华,教授、主任技师。现任武汉亚洲心脏病医院、武汉亚心总医院输血科主任。主要学会任职:湖北省微循环学会血液治疗专业委员会常委,中国医师协会输血科医师分会儿童血型专业学组委员,中国心胸血管麻醉学会血液管理分会第三届委员会委员,湖北省输血协会常务理事,湖北省输血科质控中心专家,湖北省血液管理专家委员会委员,白求恩基金会输血医学专委会常委,武汉市医学会临床输血专业委员会常委,白求恩精神研究会检验医学分会凝血与止血专业委员会委员,《中国输血杂志》审稿专家,近几年来以第一作者在《Transfusion》、《中国输血杂志》、《临床血液学杂志》等国内外期刊发表论文30余篇。主持课题2项,参与课题4项。作为副主编参译《心血管疾病生物标志物》,参编《检验与临床沟通》、《湖北省输血指南专家共识》、《临床输血个案精选》、《红细胞血清学技术》等专著。

杨杰,副主任技师,现任武汉亚心总医院输血科组长,从事临床输血治疗指导和输血管理,擅长疑难血型血清学检测和疑难特殊配血、临床输血治疗、临床大量出血与急性出血性休克的有效输血控制与合理成分输血。从事临床输血工作多年,具有丰富的临床输血治疗工作经验,主持武汉市科研项目2项,发表论文多篇。目前负责医院贫血管理小组日常工作。主要社会兼职:湖北省输血协会理事。
利奈唑胺是第一个用于临床的全合成恶唑烷酮,被广泛应用于临床严重感染患者的疾病治疗,尤其是肝肾功能不全者及老年患者。临床上,利奈唑胺主要的不良反应是血小板减少,近年来,利奈唑胺诱导血小板减少症的相关报道[1-3]越来越多。本文通过分析1例重症感染患者采用利奈唑胺治疗引起血小板减少的病例报告,阐述血小板减少的发生率及发生机制、危险因素及防治措施,探讨在临床治疗中如何更加安全合理地使用利奈唑胺。
一、临床资料
患者,男性,69岁,血液透析2月,喘息心慌2天。
1. 现病史:患者于2021年10月初在我院住院行心脏瓣膜手术时发现有慢性肾功能不全尿毒症期,行血液透析治疗,后因透析导管感染,脓毒血症,拔管,重新置管,给予抗凝、降压、改善贫血、抗感染等治疗,11月30日患者出现无明显诱因喘息、活动后心慌,间断咳嗽等症状,无咯血,无发热,无胸痛,无便血,无呕血,于12月1日在当地医院血液透析后喘息及心慌未见缓解,为求进一步诊治来我院,于12月2日再次收治入院。
2. 既往史:患者既往有心脏瓣膜病和换瓣手术史;肾功能衰竭病史,间断透析治疗;高血压病史7年余。2015年行直肠癌切除术,曾行化疗,5年前行疝气手术。既往有心律失常,阵发性心房颤动病史。否认糖尿病病史,否认肝炎、结核病史,无外伤史,否认食物、药物过敏史。
二、身体检查
患者三次入院,血小板计数动态结果如下:第一次入院时血小板计数94×109/L,后续由于心脏瓣膜手术原因一度降至55×109/L,术后逐渐回升,出院时血小板计数回升到122×109/L。后因感染第二次入院,入院后透析导管培养显示金葡萄球菌,入院时血小板计数68×109/L,入院后继续下降,最低值48×109/L,经利奈唑胺等抗感染治疗后,血小板计数逐渐回升,出院时血小板计数78×109/L。患者于2021年12月2日因喘息心慌第三次入院,入院时血小板计数6×109/L。
第三次入院其他检验检查结果如下:白细胞计数3.91×109/L,中性粒细胞百分率56.30%,血红蛋71g/L,血清尿素13.66mmol/L,血清肌酐364μmol/L,肝功能、电解质无明显异常,抗血小板因子(PF)4/肝素阴性,风湿抗体全套阴性。床旁心脏彩超:符合二尖瓣生物瓣置换+三尖瓣成形术后改变:生物瓣机能正常,三尖瓣重度反流,肺动脉高压。入院查体除贫血貌外无其他异常,肝脾肋下未及,双肾区无叩击痛,双下肢无浮肿,全身未见出血斑点。
三、临床诊断
(1)喘息心慌待查;(2)慢性肾脏病5期,血液透析,肾性贫血;(3)肺部感染 胸腔积液;(4)重度血小板减少;(5)高血压病3级,极高危;(6)心脏瓣膜病术后;(7)直肠癌个人史。
临床急需解决的问题是患者重度血小板减少原因,遂请输血科急会诊,协助诊疗。
四、血小板减少原因分析
详细了解患者的临床背景对明确血小板减少原因十分重要 ,患者三次入院,可以通过既往病史,治疗史,用药史,以及血小板基础值和血小板动态变化曲线去找到蛛丝马迹,在此基础上再有针对性进行实验室检测进行诊断和鉴别诊断。
从病人病史来看,患者在第一次入院后经诊断慢性肾功能不全尿毒症期后,间断进行血液透析治疗,而血液透析只会导致血小板轻度下降,患者出现重度血小板减少,考虑除了血液透析原因外,还有其他因素。患者透析一直使用依诺肝素抗凝,虽然有肝素诱导性血小板减少症(Heparin-induced Thrombocytopenia,HIT)的可能性,但4Ts评分4分,抗血小板因子(PF)4/肝素抗体阴性,排除HIT。患者CT增强扫描冠脉、肺动脉和大血管未见有血栓形成,并且血浆D二聚体结果1.24mg/L↑,比第二次出院时结果(3.43mg/L)相比是下降的,也不太考虑是血栓性疾病导致的血小板消耗性减少;无实验室溶血证据也排除了血栓性血小板减少性紫癜(TTP), 风湿抗体全套阴性也不考虑自身免疫性疾病导致的血小板减少,无重度感染和营养不良的证据,也排除了肝脏疾病所致。是否是近期服用了可能会导致血小板降低的药物所致?
回顾患者的用药史,患者在第二次入院后,由于血滤导管金葡萄球菌感染,于2021年11月11日开始一直使用利奈唑胺抗感染治疗,出院后继续服用,直到2021年12月2日第三次入院,血小板计数从78×109/L(2021.11.22检测)降至6×109/L(2021.12.2检测),服用利奈唑胺时间长达18d。目前用得比较多的诊断工具是根据药物不良反应因果关系评估的Naranjo[4]算法进行诊断,该病例Naranjo算法显示为7分,很可能是利奈唑胺导致的血小板减少。
五、治疗
首先停止利奈唑胺。该病例引出如下问题:(1)血小板预防性输注指征?(2)是否停用华法林抗凝治疗?停药期间如何评估血栓风险?何时再次启用华法林抗凝?重启时是否需要低分子肝素桥接?临床申请多学科讨论(MDT)。
是否应当输注血小板预防出血?预防性输注除了根据血小板计数之外,同时要评估患者有无出血危险因素。出血危险因素包括:体温超过38.5℃、败血症、凝血功能异常、贫血、广泛紫癜等,两者结合起来综合评估是否需要预防性血小板输注。患者血小板计数6×109/L,虽然患者没有出血表现,但存在贫血和肾衰等出血危险因素,出血风险高,建议尽快输注1U血小板。该患者同时也排除了血栓性血小板减少的原因(TTP和HIT),无血小板输注禁忌症。同样,由于血小板计数重度低下,出血风险高,华法林抗凝需暂时停止。
在停止抗凝期间如何评估患者的血栓风险?患者生物瓣膜置换术后,华法林抗凝至少需三个月,术后三个月内属于血栓风险高危期[5],而该患者换瓣手术后2个月,停止华法林抗凝后存在一定的血栓风险,在停药期间可以动态监测血栓指标D二聚体和凝血酶-抗凝血酶复合物(TAT),如果指标出现快速升高,可以启动边输注血小板边抗凝的策略,将血小板计数提升到安全的水平同时抗凝治疗。
血小板计数提升到什么样的安全水平,可以再次启动抗凝?这也是很多临床医生面临的非常棘手的问题,如何找到血栓与出血的平衡点?重症专家共识建议[6],血小板计数<30×109/L停止抗凝治疗;对于血液肿瘤合并VTE患者[7-8],PLT(30~50)×109/L之间时,低分子肝素剂量(LMWH)减半;PLT<30×109/L,停用或减少治疗剂量的LMWH;对于急性VTE,放置下腔静脉过滤器,预防性注射低分子肝素并输注血小板。成人原发免疫性血小板减少症诊断与治疗中国指南(2020年版)[9]单一抗血小板或抗凝治疗:PLT≥(30~50)×109/L;抗血小板联合抗凝治疗:PLT≥(50~70)×109/L。该患者存在贫血和肾衰等出血危险因素,建议PLT计数达到50×109/L以上再启动抗凝治疗。
重启华法林是否需要肝素或低分子肝素桥接?华法林的药理作用机制[10]是凝血因子I、Ⅶ、Ⅸ、X需经过γ-羧化后才能具有生物活性,而这一过程需要维生素K参与。华法林是一种双香豆素衍生物,通过抑制维生素K及其2, 3-环氧化物(维生素K环氧化物)的相互转化而发挥抗凝作用。羧基化能够促进凝血因子结合到磷脂表面,进而加速血液凝固;而华法林抑制羧基化过程。此外,华法林还因可抑制抗凝蛋白调节素C和S的羧化作用而具促凝血作用。对于高血栓风险的患者,启用华法林抗凝时为避免早期促凝的风险,同时应用肝素或低分子肝素桥接。如需快速抗凝,如VTE急性期,给予肝素或低分子肝素与华法林重叠应用5天以上。2021中国静脉血栓栓塞症防治抗凝药物的选用与药学监护指南建议[11]4类患者需要肝素类与华法林桥接治疗:(1)急性期DVT介入术后的患者;(2)VTE急性期;(3)外科围手术期;(4)肿瘤相关的VTE。该患者生物瓣膜置换术后2个月,血栓高风险期;患者在停止抗凝期间血滤管有堵塞现象,建议重启华法林抗凝同时用低分子肝素桥接。
六、治疗结果和随访及转归
该患者按MDT讨论方案进行治疗,诊疗经过及血液学指标变化曲线图见图1,患者经过停止利奈唑胺,停止抗凝,血小板输注,重组人血小板生成素(rhTPO)等治疗,血小板计数逐步回升,待血小板计数回升到61×109/L时开始启用华法林抗凝,同时用低分子肝素桥接,间断血滤,血滤抗凝剂根据血小板计数进行调整,在血小板计数低于50×109/L时血滤采用枸橼酸钠抗凝,上升到50×109/L以上采用伊诺肝素抗凝。2021年12月10日,血小板计数从入院时的6×109/L上升到87×109/L,白细胞从入院时的3.91×109/L上升到8.36×109/L,血红蛋白从入院时的71g/L上升到84g/L,血液学指标逐步改善。在12月13日心脏彩超显示:二尖瓣生物瓣周漏并重度反流,建议转心外科手术治疗或转ICU,患者家属拒绝,选择回当地医院治疗。
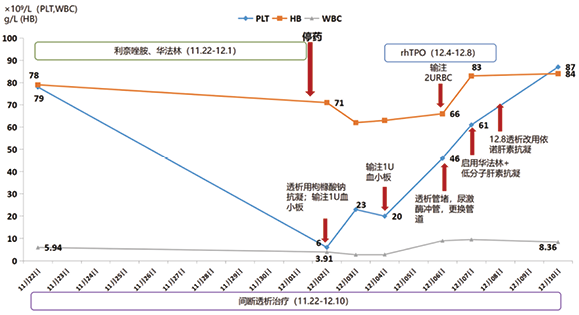
注:rhTPO重组人血小板生成素
图1. 患者治疗过程及血液学指标变化曲线图
七、讨论与分析
利奈唑胺最常见的不良反应为可逆性的骨髓抑制,包括贫血及血小板减少,其中血小板减少症的发生率为13.8%~60.5%[12]。越来越多的研究发现利奈唑胺相关血小板减少症与患者的预后相关。Kim等[13]发现重症患者使用利奈唑胺期间发生血小板减少时,其病死率升高近1倍。建立利奈唑胺相关血小板减少症的风险预测模型,有助于临床医师早期识别用药风险,为临床决策提供一定参考。不同的研究所提供地风险预测模型有所差异,Choi[14]等将肌酐清除率<30ml/min、血小板计数<150×109/L、用利奈唑胺疗程≥7d作为利奈唑胺相关血小板减少的三个方面危险因素,该病例用药前肾小球滤过率14ml/min,用药前血小板60×109/L,用药时长18d,这三个高危因素促成患者血小板大幅下降。对于肾功能不全患者或者基础血小板计数低下患者,谨慎使用利奈唑胺,即使使用,需要密切监测血小板计数,或者通过利奈唑胺药物浓度监测进行调整药物剂量,避免药物的积蓄而导致毒副作用。一旦发现血小板降低,需立即停药处理。该患者经停药处理和血小板输注,以及rhTPO等治疗之后血小板逐步回升。
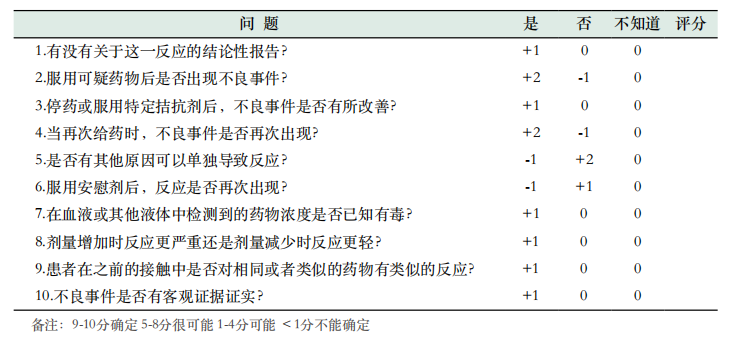
利奈唑胺药物导致血小板减少的诊断,很少通过实验室的直接证据证实,一般通过间接证据,也就是临床标准来进行诊断,可按照药物不良反应因果关系评估的Naranjo[4]算法(见表1),根据时间性、一致性、发生强度、特异性等将可疑不良反应的因果关系进行评分,评分在9~10分确定,5~8分很可能,1~4分可能,<1分不能确定。
表1. Naranjo药物不良反应概率量表的问卷调查
利奈唑胺导致血小板减少的机制研究比较少,大部分为个案报道,结论也不一致,既有骨髓抑制的报道[15],也有免疫介导的报道[16],骨髓抑制可能机制:可能通过促进肌球蛋白轻链2(MLC2)磷酸化来抑制成熟巨核细胞释放血小板,进而导致血小板减少症的发生。不同的机制导致血小板减少的治疗侧重点也不一样,对于骨髓抑制,可以通过TPO治疗,如果是免疫介导导致血小板减少可以通过激素和丙种球蛋白冲击治疗。两种机制导致血小板下降的时间点,下降的幅度和停药后恢复时间也有所区别,药物介导的免疫性血小板减少症常伴有较高的出血风险,一般在药物暴露5~10d后出现血小板减少,并且会出现日降幅最大,达到50%下降程度,中位血小板计数常<20×109/L。血小板计数通常在停药4~5个药物半衰期后开始恢复,恢复较快1~2d开始上升,1周内恢复正常。骨髓抑制机制,通常呈现剂量和时间依赖性,用药后7~10d开始下降,这个时间节点也符合血小板生存期,此后下降缓慢,停药后继续下降,停药后3~4d达最低点,5~7d开始回升,1~2周恢复。该病例用药后三系减少,停药后上升缓慢,激素治疗效果不佳,rhTPO治疗效果好,考虑骨髓抑制为主。
关于药物所致的血小板减少症患者是否需要输注血小板,需结合血小板计数、是否存在出血或者出血危险因素综合考虑[17]。当血小板减少症患者同时需要进行抗凝治疗时,血小板减少的主要危险是出血,但血小板减少不能阻止血栓的发生,血小板减少并非血栓的保护因素,若血小板减少合并出现血栓,治疗中需结合患者疾病类型、既往出血或血栓史、合并症、血小板减少持续的时间和程度、血小板功能障碍、凝血异常等进行综合判断出血与血栓形成风险,依据临床情况选择不同抗栓治疗或将血小板提高到安全水平保证抗栓治疗的安全进行。总体而言,血小板计数≥50×109/L的患者给予抗血栓治疗是相对安全的;血小板<30×109/L,停止抗凝治疗;而血小板介于(30~50)×109/L时,目前抗血栓治疗未达成共识,需个体化评估。血栓风险高的血小板减少患者在停止抗凝期间,可动态监测血栓指标,比如D-二聚体和TAT,如果呈现快速提升,考虑要尽快启动抗凝,同时进行血小板输注提升血小板计数,避免血小板过低导致的出血,采取边补充血小板边抗凝的策略。
结论:本研究报道了1例重症感染患者采用利奈唑胺治疗引起血小板减少的病例,该患者使用利奈唑胺后第18天出现血小板减少,停药3天后血小板数量开始上升,结合不良反应关联性评价结果,该患者出现血小板减少很可能与其服用利奈唑胺相关。目前,利奈唑胺诱导血小板减少症的发生机制尚不明确,长疗程用药、肾功能不全、基线时血小板计数低是利奈唑胺诱导血小板减少症的独立危险因素。临床医生要加强实验室监测,提高早期防范意识,避免药物不良反应发生。
参考文献
张艳仙, 王新宇, 邹艳红, 蒋睿, 张福莉. 重症患者使用利奈唑胺致血小板减少1例[J]. 临床合理用药志, 2021, 14(13): 158-159. DOI: 10.15887/j.cnki.13-1389/r.2021.13.068.
夏天一, 刘志玲, 朱曼, 郭代红, 姚翀. 利奈唑胺注射液致血小板减少的主动监测与评价研究[J]. 中国医院药学杂志, 2021, 41(24): 2564-2568,2 596. DOI: 10.13286/j.1001-5213.2021.24.11
Qin Y, Chen Z, Gao S, et al. Development and Validation of a Risk Prediction Model of Linezolid-induced Thrombocytopenia in Elderly Patients[J]. 2021. DOI:10.21203/rs.3.rs-582799/v1.
NARANJO CA, BUSTO U, SELLERS EM, et al. A method for estimating the probability of adverse drug reactions[J]. Clin Pharmacol Ther, 1981; 30(2): 239-245.
赵振刚. 2017年美国心脏病学会/美国心脏协会心脏瓣膜病患者管理指南更新: 要点解读及前景展望[J]. 华西医学, 2018年33卷2期, 173-187页, ISTIC CA, 2018. DOI: 10.7507/1002-0179.201801145.
Leader A, Cate V T, Cate-Hoek A J T, et al. Anticoagulation in thrombocytopenic patients with hematological malignancy: A multinational clinical vignette-based experiment[J].European Journal of Internal Medicine, 2020, 77. DOI: 10.1016/j.ejim.2020.03.005.
Napolitano M, Saccullo G, Marietta M, et al. Platelet cut-off for anticoagulant therapy in thrombocytopenic patients with blood cancer and venous thromboembolism: an expert consensus[J]. Blood transfusion = Trasfusione del sangue, 2018: 1. DOI:10.2450/2018.0143-18.
Lim M S, Enjeti A K. Safety of anticoagulation in the treatment of venous thromboembolism in patients with haematological malignancies and thrombocytopenia: Report of 5 cases and literature review[J]. Critical reviews in oncology/hematology, 2016, 105: 92-99.DOI: 10.1016/j.critrevonc.2016.06.011.
侯明, 胡豫. 成人原发免疫性血小板减少症诊断与治疗中国指南 (2020年版) [J]. 中华血液学杂志, 2020(8): 617-623.
中华医学会心血管病学分会,中国老年学学会心脑血管病专业委员会. 华法林抗凝治疗的中国专家共识[J]. 中华内科杂志, 2013, 52 (001): 76-82. DOI: 10.3760/cma.j.issn.0578-1426.2013.01.027.
王乔宇, 武明芬, 柳鑫, 等. 2021中国静脉血栓栓塞症防治抗凝药物的选用与药学监护指南[J]. 中国临床药理学杂志, 2021, 37(21): 18. DOI: 10.13699/j.cnki.1001-6821.2021.21.032.
刘彦鑫, 刘婷婷, 魏歌, 等. 利奈唑胺相关血小板减少症的危险因素分析及其风险预测模型的建立[J]. 解放军医学杂志, 2021, 46(8): 6. DOI: 10.11855/j.issn.0577-7402.2021.08.06.
Kim HS, Lee E, Cho YJ, et al. Linezolid-induced thrombocytopenia increases mortality risk in intensive care unit patients, a 10 year retrospective study[J]. J Clin Pharm Ther, 2019, 44(1): 84-90.
Choi, Go WunLee, Ju-YeunChang ,et al.Risk factors for linezolid-induced thrombocytopenia in patients without haemato-oncologic diseases[J].Basic & clinical pharmacology & toxicology. 2019, 124 (S1). DOI:10.1111/bcpt.13123.
宋景春, 刘树元, 朱峰, 等. 中国成人重症患者血小板减少诊疗专家共识[J]. 解放军医学杂志, 2020, 45(5): 18. DOI: 10.11855/j.issn.0577-7402.2020.05.01.
Pascoalinho D, Vilas M J, Luís Coelho, et al. Linezolid-related immune-mediated severe thrombocytopenia [J]. Int J Antimicrob Agents, 2011, 37(1): 88-89. DOI: 10.1016/j.ijantimicag.2010.10.001.
Guidelines for the use of platelet transfusions [J]. British Journal of Haematology, 2017. DOI: 10.1111/bjh.14423.




