高级别前列腺癌18基因的尿液检测方法的建立与验证
【摘要】意义:单独使用前列腺特异性抗原(PSA)筛查前列腺癌(PCa)的益处在很大程度上被过度阴性活检和PSA对高级别PCa(即级别组[GG]2或更高)的特异性差而导致惰性癌症的过度检测所抵消。目的:开发用于高级别PCa的多重尿液检测面板(panel),并验证其相对于当前指南认可的生物标志物的外部性能。方法:对58,724个基因的RNA测序分析确定了54个PCa标志物,包括17个在高级别癌症中特异过表达的标志物。在针对高级别PCa的新尿液检测(MyProstateScore 2.0[MPS2])中对基因表达和临床因素进行了建模,在前列腺体积(MPS2+)和不考虑前列腺体积(MPS2)的情况下并行建立最优模型,模型在美国癌症研究所前瞻性试验队列中进行了盲法外部验证,数据收集时间为2008年1月至2020年12月,数据分析时间为2022年11月至2023年11月。路径:规范化的血液和尿液采集以及经直肠超声引导下的系统性前列腺活检。结果:纳入开发(训练)队列的761例男性中位年龄(IQR)为63(58-68)岁,中位PSA水平(IQR)为5.6(4.6-7.2)ng/mL;743例男性纳入验证队列,年龄中位数(IQR)为62(57-68)岁,PSA水平中位数(IQR)为5.6(4.1-8.0)ng/mL。在验证队列中,151例(20.3%)活检为高级别PCa,使用单独PSA、风险计算器、PHI、衍生的多重2基因模型、多重3基因模型和原始MPS模型的受试者工作特征(ROC)曲线下面积(AUC)分别为0.60、0.66、0.77、0.76、0.72和0.74,而使用MPS2模型和MPS2+模型的ROC曲线下面积分别为0.81和0.82。在95%的灵敏度下,MPS2模型将减少在初始活检人群中进行的不必要活检(其他检查可避免15%-30%;MPS2可避免35%-42%)和重复活检人群(其他检查为9%-21%;MPS2为46%-51%)。在相关亚组中,MPS2模型对GG≥2的癌症的阴性预测值为95%-99%,对GG≥3的癌症的阴性预测值为99%。 结论:在验证队列中评估了多项生物标志物检测,包括血清PSA、前列腺癌预防试验(Prostate Cancer Prevention Trial)风险计算器和前列腺健康指数(PHI),以及衍生的多重2基因和3基因模型、原始的2基因MPS检测和18基因MPS2模型,在对GG2或更高级别的PCa具有95%灵敏度的检测方法下,我们计算了诊断准确性和检测的临床结果,其次评估GG3或更高级别的癌症。结论与相关性:在这项研究中,与现有的生物标志物检测相比,一种新的18基因PCa检测方法对高级别PCa具有更高的诊断准确性。在临床上,使用该检测将有意义地减少不必要的活检,同时保持对高级别癌症的高灵敏度。这些数据支持在PSA水平升高的患者中使用这种新的PCa生物标志物检测方法,以减少PCa筛查的潜在危害,同时保持其长期获益。
前列腺癌(PCa)仍然是全球最常见的恶性肿瘤和癌症死亡的主要原因, 欧洲前列腺癌筛查随机研究和哥德堡随机前列腺癌筛查试验显示,参与基于前列腺特异性抗原(PSA)筛查的男性癌症死亡率显著降低。与此同时,这些研究证实,PSA筛查会导致未患癌症的男性进行不必要的有创活检,并经常过度诊断低级别惰性癌症(级别组[GG]1)。针对这一问题,现行临床指南建议,PSA水平升高的男性在活检前应接受多参数磁共振成像(mpMRI)(如果有的话)或用于风险分层的生物标志物检测。事实上,对于在mpMRI上可见肿瘤的男性,使用前列腺mpMRI和靶向活检提高了有临床意义的高级别癌症(即GG2或更高级别)的检出率。虽然这些数据支持对需要活检的患者进行活检前的mpMRI检查,但在PSA水平升高的男性中,利用mpMRI阴性结果来排除高级别癌症尚未得到充分支持。横跨学术和社区机构的人群水平数据显示,对于高级别癌症,mpMRI的阴性预测值(NPV)仅为77%,而且对mpMRI的主观解读存在很大问题,各研究中心的NPV低至63%,放射科医师的NPV低至40%。因此,即使mpMRI结果为阴性,对于相当大比例的男性,mpMRI有限的灵敏度也值得活检,此外,mpMRI可能无法在PSA后在人群中广泛使用,有一些实际原因,包括其资源负担和在社区环境中有限的可用性。
无创生物标志物检测可能是一种更实用的选择,目前的美国国立综合癌症网络(NCCN)指南提供了6种基于血液和尿液的生物标志物测试,每种测试包括3种或更少的PCa标志物(即任何级别的癌症)。虽然这些检测法的性能始终优于单独的PSA,但尚未发展到反映当前对PCa生物学的理解。鉴于低级别癌症的转移潜力很小,目前的工作重点是检测高级别癌症,同时减少对低级别癌症的过度诊断。因此,仅基于与任何级别的癌症相关标志物的检测对高级癌症的生物学特异性有限。此外,仅包括2-3个生物标志物检测根本无法捕获驱动致命疾病的多种不同分子途径。我们假设,用高级别、侵袭性癌症选择性表达的新分子增强上一代癌症相关生物标志物将提高检测的准确性,利用多机构的转录组数据,确定了高级别癌症特异性过表达的新基因,然后采用基于PCR技术在开发队列中评估了54个候选标志物,获得了适合标准临床应用的最佳18基因检测,最后,对新检测法进行了盲法外部验证,包括与目前认可的生物标志物检测进行直接比较。
一、研究对象与方法
每个中心均获得了密歇根大学机构审查委员会的批准,所有参与者均提供了书面知情同意书,本研究遵循诊断试验准确性研究报告标准(STARD)。
1. 生物标志物发现:最初的MyProstateScore(MPS)检测纳入了前列腺癌抗原3(PCA3)和TMPRSS2:ERG基因融合表达以及血清PSA水平,以估计高级别癌症的风险,并得到了NCCN指南的支持,用于活检前的风险分层。为了获得高级别癌症的基因panel,我们对多机构RNA测序数据中的58,724个遗传靶点进行了差异表达分析(图1),共有72个基因符合预先定义的癌症(n=50)或高级别癌症(n=22)的提名标准,去除共线性基因和那些没有PCR引物的基因,产生44个候选标志物。这些标志物补充了之前描述的10个PCa相关或内参基因,产生了54个基因候选panel。
2. 模型开发:(1)开发队列:自2008年以来,根据密歇根大学机构审查委员会批准的美国国家癌症研究所(NCI)早期检测研究网络(EDRN)协议,密歇根大学前列腺卓越研究专业计划前瞻性收集了活检前尿液。直肠指检后获取首次采集的尿液,与RNA稳定缓冲液混合,并在-70℃冷冻。开发队列包括2008-2020年因PSA水平升高(3-10ng/mL;换算为μg/L,乘以1)而就诊,接受≥12针前列腺活检的患者。根据指南排除了PCa患者,建议将该检查作为mpMRI前检查和活检前检查,以排除对mpMRI或活检的需求,因此我们排除了有前列腺mpMRI和靶向活检病史的男性。(2)多重定量PCR OpenArray分析:(3)OpenArray技术是一种高通量实时定量PCR(qPCR)方法,用于快速筛选多种TaqMan分析,进行RNA分离,提取和互补DNA合成。(4)模型构建和校准:使用多种模型构建策略评估了54个基因候选组合(图1),与PCa一致相关的临床因素(年龄、种族、直肠指检结果、PSA水平、前列腺癌家族史和既往活检阴性)被预先锁定在模型中。由于前列腺体积可提高预测价值,但并非对所有患者均可用,因此我们开发了第二个模型,其中包括体积,以便在临床可用体积时使用(即既往活检或mpMRI)。将检测结果标准化以表示检出高级别癌症的可能性百分比(0%-100%)。校准无前列腺体积(MPS2)和前列腺体积(MPS2+)的最佳18基因模型,以解释队列之间结果发生率的差异,将校准的模型锁定以进行外部验证,MPS2检测由LynxDx所有,该公司已获得密歇根大学的商业化独家许可。
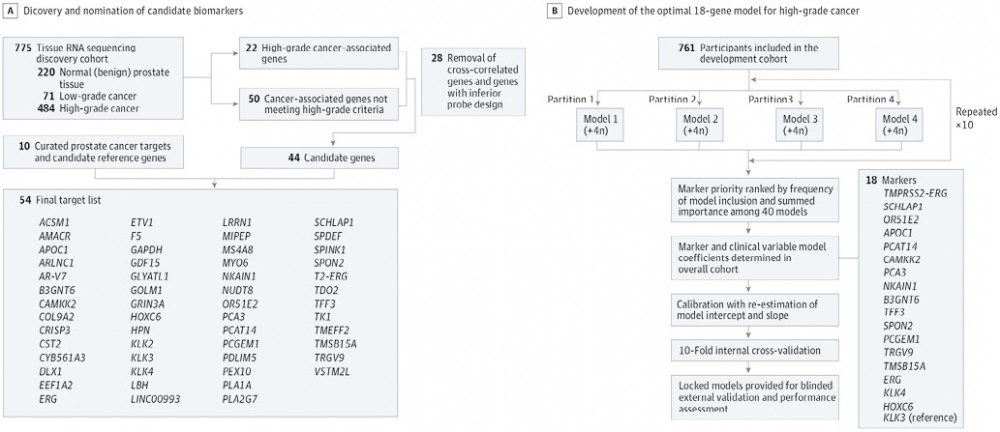
注:A.多重尿液panel候选生物标志物的发现和提名;B. 高级别癌症最佳18基因模型的建立
图1. 高级别前列腺癌症MyProsecore2.0尿液检测的生物标志物发现
3. 模型验证:(1)外部验证队列:验证队列由前瞻性NCI EDRN PCA3评估试验的患者组成,本试验纳入了在11个学术中心连续接受活检的患者,主要是因为PSA水平升高或直肠指检结果异常。患者通过问卷报告种族:可选选项包括美洲印第安人或阿拉斯加原住民、亚洲人、黑人、夏威夷原住民或其他太平洋岛民、白人、其他或未知种族。鉴于黑种人与PCa发病率、结局和分子亚型的已知关联,我们认为黑种人与本研究相关。由于这种关联在其他种族群体中没有很好地建立起来,并且由于黑人和白人以外的种族群体经常被错误分类,因此种族群体被归类为黑种人或其他种族。(2)样本和实验室分析:隐去身份的尿液样本被送往密歇根大学进行OpenArray分析,实验室按照开发中使用的相同方案进行。我们建立了一个多重2基因模型(HOXC6和DLX1)和一个多重3基因模型(PCA3、ERG和SPDEF)。这些基因分别在市售的SelectMDx和ExoDx前列腺智能评分(EPI)测试中进行检测,本文多重模型是OpenArray qPCR平台测定的基因表达独立导出的,不建议代表商业产品。使用约翰霍普金斯大学EDRN实验室的Access2免疫测定系统(Beckman Coulter)测定了血清PSA、游离PSA和[-2]proPSA。(3)盲法验证和比较分析:NCI EDRN的2位研究人员可以使用表达数据和模型系数进行预定义验证。开发过程中的锁定模型系数用于生成衍生多重2基因、多重3基因模型、MPS2和MPS2+的输出。使用基于qPCR的PCA3和TMPRSS2:ERG评分计算原始MPS,之前已经描述了一部分数据,前列腺健康指数(PHI)计算公式为([-2]proPSA/游离PSA)×√(PSA)。比较分析包括PSA、前列腺癌预防试验风险计算器、PHI、衍生的多重2基因和3基因模型、MPS、MPS2和MPS2+。主要结果是活检时GG2或更高的癌症,对GG3或更高级别的癌症进行二次评估。诊断潜力通过ROC曲线可视化,并使用R包pROC通过ROC曲线下面积(AUC)量化。对于开发队列,报告了重复10倍交叉验证的平均AUC,对于验证队列,采用2000分层bootstrap法计算AUC的95% CI。我们试图使用一种直接的、临床适用的方法来说明测试性能,如前所述,考虑到检测人群中高级别癌症的患病率(17%-31%)、假阴性和假阳性检测结果的相对危害以及生物标志物在排除检测中的作用,我们评估了对高级别癌症具有95%灵敏度的阈值。使用R包caret的confusionMatrix函数计算性能指标,考虑到初始和重复活检人群的风险特征不同,在每个亚人群中进行了分析。决策曲线分析(DCA)用于量化与(1)对所有患者进行活检和(2)不进行活检相比,每种生物标志物在做出活检决策方面的净获益。考虑到在大多数患者中,超过20%的高级别癌症风险适合进行活检,低于5%的风险适合放弃活检,我们评估了涵盖这一临床相关范围的阈值概率,DCA使用R包dcurves中的DCA进行。
4. 统计学分析方法:使用R 4.1.1版(The R Foundation)进行统计学分析,所有比较均采用双尾检验,P值小于0.05被认为具有统计学意义。
二、研究结果
1. 模型开发:在开发队列的815名参与者中,qPCR在761名(93.4%)中产生了有效结果,中位(IQR)年龄为63(58-68)岁,中位(IQR)PSA水平为5.6(4.6-7.2)ng/mL(见表1)。在研究活检中,293名男性(38.5%)患GG 2或更高级别的癌症,通过弹性网络模型定量分析了候选基因对模型预测的贡献(见图1)。最终的MPS2模型包括临床变量和17个信息最丰富的标志物,包括来自开发分析的13个标志物(4个高级别癌症特异性基因[APOC1、B3GNT6、NKAIN1和SCHLAP1]、9个癌症特异性基因[PCGEM1、SPON2、TRGV9、PCA3、OR51E2、CAMKK2、TFF3、PCAT14和TMSB15A])、4个精选标志物(HOXC6、ERG、TMPRSS2:ERG和KLK4)以及参考基因KLK3。在整个队列中确定模型系数,进行校准和内部交叉验证,并锁定MPS2模型进行外部验证。
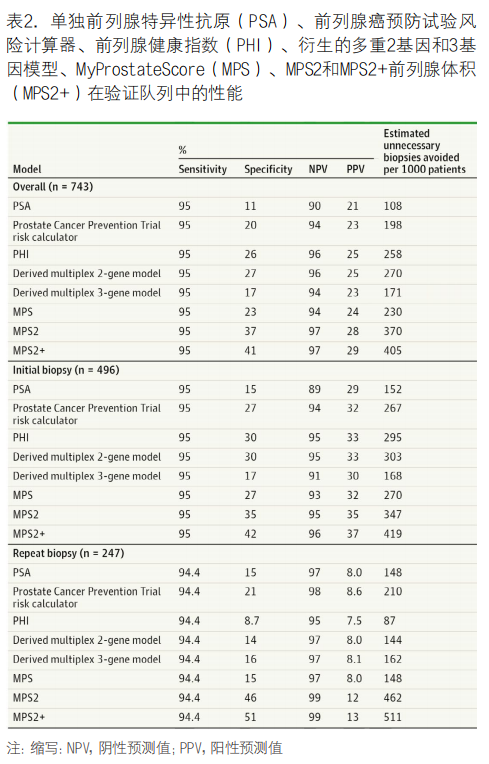
2. 研究人群:在验证队列的813名患者中,qPCR在743名(91.4%)产生有效结果,中位(IQR)年龄为62(57-68)岁,中位(IQR)PSA水平为5.6(4.1-8.0)ng/mL。共有95名男性(12.8%)为黑人,648名(87.2%)为另一种族,247名男性(33.2%)之前的活检结果为阴性(见表1)。在研究活检中,151名男性(20.3%)患有高级别PCa,GG2或更高的男性(0.44[0.23-0.69])的中位(IQR)MPS2值显著高于活检阴性的男性(0.08[0.03-0.19];P<0.001)和GG1男性(0.20[0.08-0.43];P<0.001)(见表1)。同样,PCa为GG2或更高(0.54[0.27-0.79])的男性的中位(IQR)MPS2+值显著高于活检阴性的男性(0.08[0.03-0.21];P<0.001)或GG1癌患者(0.25[0.09-0.48];P<0.00)。高级别癌症的AUC值单独PSA为0.60(95% CI,54.7-64.6),前列腺癌预防试验风险计算器为0.66(95% CI,61.1-70.7),PHI为0.77(95% CI,73.0-81.3),衍生多重2基因模型为0.76(95% CI,71.9-80.3),衍生多重3基因模型为0.72(95% CI,67.0-76.1),MPS为0.74(95% CI,69.4-78.0),而0.81 MPS2(95% CI,76.9-84.6),MPS2+为0.82(95% CI,78.1-85.5)。观察到的高级别癌症患病率与MPS2和MPS2+预测概率非常接近(见图2),反映出良好的校准。至关重要的是,这些模型针对低于30%的预测概率进行了良好的校准,这与临床最为相关。我们评估了活检前生物标志物检测的临床结果,在95%灵敏度检测阈值时,对于PSA、前列腺癌预防试验风险计算器、PHI、衍生多重2基因模型、衍生多重3基因模型和MPS,本可避免的不必要活检比例分别为11%、20%、26%、27%、17%和23%,而MPS2和MPS2+分别为37%和41%。表2列出了每1,000例患者的完整性能指标和避免不必要活检的估计数量,重要的是,MPS2和MPS2+分别为GG3或更高级别的癌症提供了99%的灵敏度和99%的NPV。
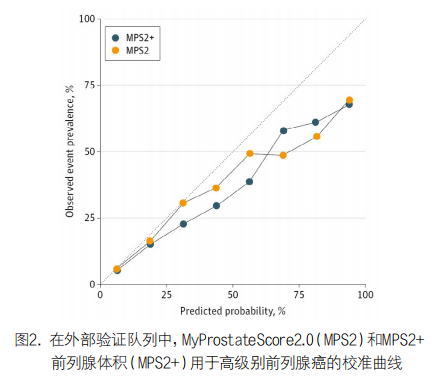
3. 初始活检亚群:初始活检人群包括496名中位(IQR)PSA水平为5.0(3.8-6.6)ng/mL的患者。在研究活检中,133例(26.8%)患高级别癌症。使用95%的灵敏度阈值,对于PSA、前列腺癌预防试验风险计算器、PHI、衍生多重2基因模型、衍生多重3基因模型和MPS,避免不必要活检的比例分别为15%、27%、30%、30%、17%和27%,而MPS2为35%(见表2)。虽然接受初始活检的患者通常可能没有可用的前列腺体积,但使用MPS2+可以避免42%的不必要活检,我们在开发队列的初始活检人群中开发了另一种初始活检模型,并进行了类似验证。
4. 重复活检亚群:重复活检人群包括247名中位(IQR)PSA水平为7.2(5.5-9.8)ng/mL的男性,其中18名(7.3%)被发现患有高级别癌症。在95%的灵敏度下,对于PSA、PHI、衍生的多重2基因模型、衍生的多重3基因模型、MPS、MPS2和MPS2+,可避免的不必要活检比例分别为15%、8.7%、14%、16%、15%、46%和51%(见表2),因此,MPS2检测可避免约一半的不必要活检,同时保持94.4%的高级别癌症检出率。
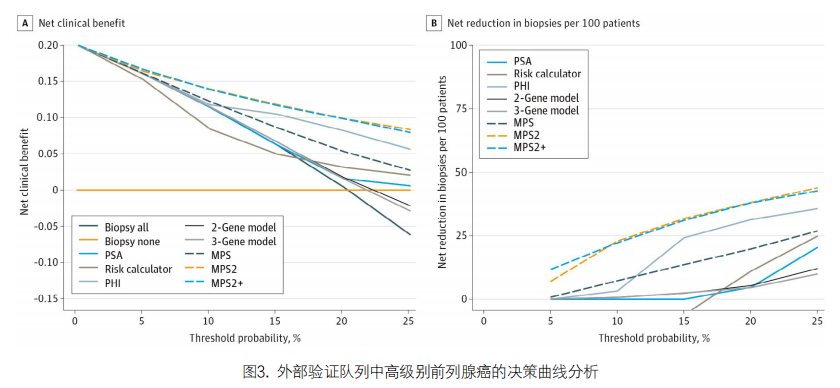
5. DCA:DCA用于评估生物标志物检测相对于所有患者进行活检和不进行活检的净获益。在5%-20%的临床相关阈值概率范围内,在所有检验中,使用MPS2模型将产生最高的净临床获益(见图3A)。将益处表示为不必要活检的净减少,则使用MPS2模型将在未对1例高级别癌症患者进行活检的情况下最大限度地减少不必要活检(见图3B)。
三、讨论与分析
由于低级别PCa的惰性,现在指南强调将诊断重点缩小到高级别PCa。因此,所有前列腺癌(包括低级别、惰性肿瘤)表达的现有生物标志物在选择性检测高级别前列腺癌方面的潜力有限,我们将基于测序的发现转化为可扩展的qPCR平台,开发并验证了一种包含17种癌症标志物的新尿液检测方法,并且在我们的知识范围内,首次发现了高级别癌症相对于低级别特异过度表达的新型标志物。经验证,在各亚组中,对于高级别癌症,灵敏度为95%的MPS2检测法具有95%-99%的NPV和35%-51%的特异性。对于个别患者,接近100%的NPV为有把握的决策提供了明确的指导。对于临床医生而言,统一使用MPS2可避免不必要的活检,同时保留使用活检全方法诊断的95% GG2或更高级别的立即检测。重要的是,MPS2对于GG3或更高级别的癌症具有99%的灵敏度和99%的NPV,这意味着罕见的假阴性MPS2结果几乎都是GG2最不可能转移的、病情较好的癌症。
2023年NCCN PCa早期检测指南建议考虑使用经过验证的生物标志物检测(包括PHI、SelectMDx、4Kscore、EPI、MPS和IsoPSA)进行活检前风险分层,这些检测的性能始终优于单独PSA,对于高级别癌症,总体数据的灵敏度约为90%-95%,特异性约为30%-40%。然而,已发表数据的异质性和缺乏直接比较排除了任何特定检测方法的建议,我们利用有临床指征进行生物标志物检测的NCI队列,直接比较了用于高级别PCa的新18基因检测与现有指南认可的检测方法。总的来说,MPS2模型的AUC值与现有选项相比具有显著的改善意义。采用对高级别癌症具有95%灵敏度的方法,MPS2相对于其他检测方法可以显著减少不必要的活检数量,这些数据支持使用MPS2来减轻筛查的潜在危害,同时保留其长期获益。
既往活检阴性的患者面临独特的挑战,由于大多数患者因PSA升高而接受初次活检,因此重复PSA检测的价值在该人群中特别有限。在之前的一项研究中,在229例接受重复活检的患者中,EP检测对高级别癌症的灵敏度为82%,特异性为27%。在268例接受重复活检的患者中,MPS提供了100%的灵敏度和23%的特异性。本次分析中的247例患者,94.4%灵敏度下,MPS2+的特异性为51%,而PHI为8.7%,衍生的多重2基因模型为14%,衍生的多重3基因模型为16%,MPS为15%。这些发现虽然令人震惊,但似乎是合理的,因为目前大多数检测都包括PSA和PSA亚型,强调了对PSA的持续依赖。其次,现有检测法只检测3种或更少的非PSA标志物,考虑到驱动致死性PCa的多种途径,很难想象大多数具有侵袭性的癌症会在疾病早期就过度表达为数不多的标志物之一,通过捕获17种与癌症相关、不依赖PSA的标记物,MPS2提供的广度是之前检测的大约5倍,并有望开发出不依赖PSA的新一代生物标记物。
理想的诊断检测被描述为安全、准确、可用、可操作,并提供良好的利弊比。虽然PSA本身具有良好的实用特性,但其缺乏癌症特异性,因此需要一种补充检查来改善筛查结局。虽然活检前mpMRI可以提高mpMRI阳性结果的男性高级别癌症的检出率,但使用阴性mpMRI结果排除显著癌症的数据值得关注。一项全州合作研究的结果显示,在不同的环境下NPV仅为77%。即使在经验丰富的中心,主观MRI判读也会产生显著差异,一个中心的NPV低至63%,而个别放射科医师的NPV低至40%。此外,MRI带来了巨大的时间和资源负担,无法在社区广泛开展,而且对一些患者来说也不是一种选择,这对其广泛应用构成了重大障碍。虽然MRI是诊断设备中有价值的组成部分,但实际应用的局限性和欠佳的排除性能表明,MRI可能最好在诊断过程的后期使用,例如,提高最有可能从侵入性检查中获益的男性活检率。
MPS2的准确性提供了在初级保健水平直接应用的可能性(即,阴性检测排除高级别疾病;阳性检测提示专科转诊)。对于专科医师而言,为患者提供早期无创的分子肿瘤数据可以使其获得更全面、个体化癌症治疗。例如,在需要活检的患者中,肿瘤亚型与MRI可见度的关系可以帮助识别可能从活检前mpMRI获益的患者以及那些更适合立即活检的患者。在GG1前列腺癌患者中,高级别标志物可能提示存在隐匿性侵袭性肿瘤,而没有这些标志物可能无需定期监测活检。最后,活检和基于组织的检测依赖于采样的特定肿瘤灶,而尿液提供了对前列腺基因表达的全面评估,这是减轻活检取样局限性的理想补充。
局限性问题,目前的研究具有局限性,首先,研究人群的种族多样性有限,因此,目前尚不清楚我们的发现在黑人男性中有何差异,我们目前正在进行分析,以确保对所有患者进行最佳检测。其次,参考标准是系统活检,这可能会导致采样不足,相对于手术病理学,采样不足可能会增加NPV并降低阳性预测值。尽管如此,抽样错误分类预计会对所有测试产生同等影响,我们独特地将MPS2与现有生物标志物检测进行了头对头比较。此外,在有更明确病理数据(如根治性前列腺切除术)的患者中重复了模型开发,结果发现前列腺切除术衍生的MPS2模型无显著差异。值得注意的是,目前的分析使用了前列腺癌预防试验风险计算器,因为它得到了临床医生的广泛验证和认可,其他风险计算器的表现可能会有所不同。
我们承认在其他平台上开发分子模型的局限性,虽然衍生的多重模型包含了其他市售检测方法的组成部分,但不应将这些模型解读为与市售检测方法等效,就像无法就未评估的生物标志物得出结论一样。尽管如此,据我们所知,之前从未对新验证的检测方法与指南认可的检测方法进行过外部比较,而与目前的检测方法相比,18基因检测将在临床上有意义地提升高级别PCa的准确性。虽然这些发现令人鼓舞,但不能排除其他队列的不同发现。此外,95%的灵敏度阈值是一个单一的数据点,虽然具有说明性和临床适用性,但可能并不适合所有人群,本文提出的决策曲线提供了更广泛的关于效用的信息。最后,该研究人群不适合将生物标志物与mpMRI进行比较,mpMRI仍然是一个关键的知识鸿沟,目前正在进行这项评估的前瞻性多中心试验。无论如何,MPS2的外部验证性能支持其准确排除mpMRI和活检需求的有效性,需要进一步的研究来证实这些数据,并确认观察到的MPS2测试对长期结果的积极影响。
四、结论
在这项研究中,在转诊接受前列腺活检的外部验证人群中,18基因尿液检测对高级别PCa的诊断准确性高于目前的检测方案。在临床上,使用该检测方法可以安全地避免35%-51%的患者接受不必要的影像学或活检检查,同时保持从早期检测中获益的高级别癌症的高灵敏度。这些发现表明,在PSA水平升高的患者中使用该测试可以减少前列腺癌筛查的潜在危害,同时保留其长期获益。
编译节选自:《JAMA Oncol》.Published online April 18, 2024.




