原发性胆汁性胆管炎一例诊疗分析
一、患者诊疗信息
2024年3月22日下午,本院接到内科请求到门诊分析检验报告单。该患者来医院复查血细胞分析、肝功和肝胆脾超声。超声显示“胆囊壁欠光滑,肝胆脾结果未见明显异常”,血细胞分析和肝功结果分别见表1和表2。
表1. 血细胞分析检验结果
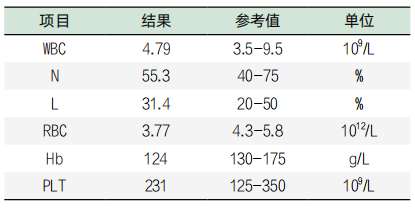
表2. 部分肝功检验项结果目
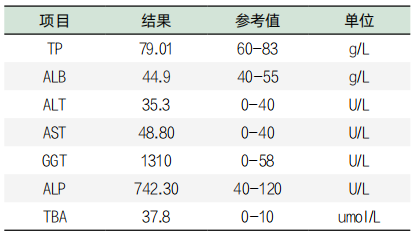
患者的GGT、ALP和TBA异常升高,分别超过正常参考值上限的22.53倍、6.18倍和3.78倍。患者自诉2023年9月曾在本院内四科住院治疗,遂到病案室查阅病历。病历显示患者曾在2023年9月2日在本院内四科住院。病历显示:“主诉:反复咳嗽、气短8年,再发3天。现病史:患者于入院前8年无明显诱因出现反复咳嗽、咳痰,每遇冬季时症状加重,持续时间约3个月,天气转暖时好转,曾就诊于有院诊断为慢性支气管炎,给予抗炎平喘等治疗,症状仍有反复,在当地间断用药治疗,具体不详。入院前3天患者受凉后出现咳嗽,少量白黏痰,气喘较前加重,食欲差,偶有头晕、恶心全身乏力。CT显示:双肺支气管炎,冠脉钙斑。以“呼吸困难”入院治疗。病人有高血压7年,不规律服药治疗。出院诊断:“急性喘息性支气管炎”和“高血压”。历次血细胞检查结果和肝功检查结果见表3和表4。
表3. 住院期间血细胞和炎性指标检验结果
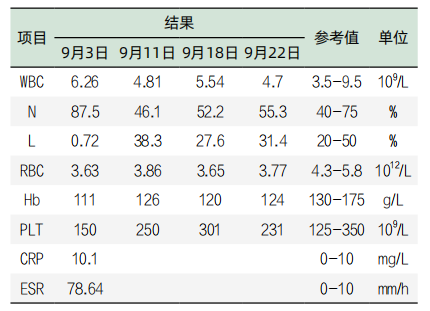
表4. 住院期间部分肝功检验结果
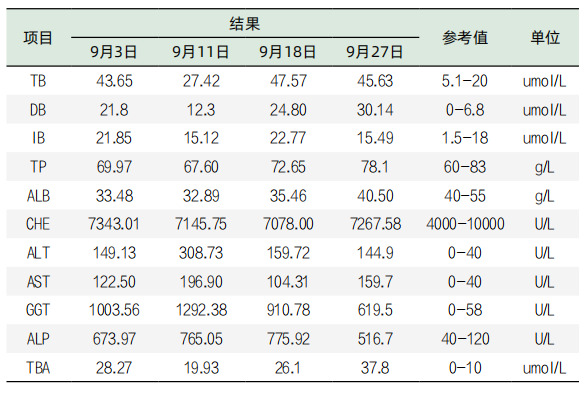
患者血凝结果、尿液检查、常检肿瘤标志物和乙肝五项未见异常;2023年9月6日CT腹部扫描和超声结果显示肝胆脾结构未见异常。
二、临床诊疗分析
患者哪几项检查结果异常?上述结果显示,GGT、ALP等结果异常升高,肝功能各项检测结果的平均值与正常参考值上限的比值见表5。表5显示,升高异常程度最高的项目是GGT,其平均值是正常参考值上限的16.50倍,其次依次为ALP,为5.7倍。
表5. 住院期间部分肝功检验结果的平均值与其上限的比值
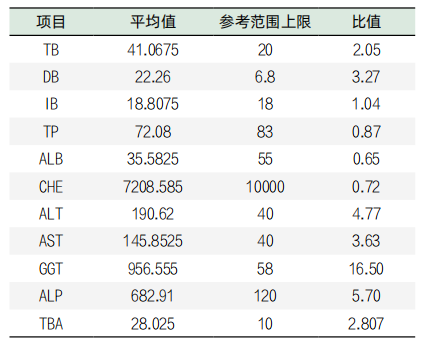
GGT简称转肽酶,血清酶毛细胆管上皮,当毛细胆管局部压力增大时经过基底膜进入血液。血清GGT病理性升高的程度依次为肝外胆道梗阻、原发性肝癌、肝内胆汁淤积、急性肝炎、肝硬化、中重度慢性肝炎[1]。肝外胆道梗阻常见的疾病为胆总管结石、肿瘤和胰腺炎等,2023年9月影像学检查结果肝胆脾结构未见异常,故建议进一步进行影像学的相关检查。
原发性肝癌主要包括肝细胞癌、肝内胆管癌和混合型肝细胞-胆管癌。本患者虽有黄疸,但无肝脏增大和腹水等体征;虽然AFP等肿瘤标志物阴性,但由于AFP阴性也不能排除原发性肝癌,故建议检验肿瘤标志物,并外送金域检验肝癌三项(AFP、AFP-L3、AFP-L3/AFP)。
肝内胆汁淤积常见的原因为自身免疫性肝炎或自身免疫性肝损害、药物性肝损害、酒精性肝损害和脂肪肝、肥胖症和高血压等[1]。该患者CHE结果正常,初步排除药物性肝损害所致[2];经了解患者平时不涉及酒精,故排除酒精性肝损害所致;根据患者体重身高,排除肥胖症所致;以“高血压”和“肝内胆汁淤积”为关键词在“中国知网”上搜索,只发现妊娠高血压引起的肝内胆汁淤积的报道,未发现高血压引起肝内胆汁淤积的相关报道,初步排除高血压所致。建议患者检验免疫球蛋白(Ig)和补体,并外送金域检验IgG4、抗核抗体(ANA)和自身免疫性肝病八项(抗线粒体亚型-2抗体(AMA2)、抗可溶性肝抗原/肝胰抗原抗体、抗肝肾微粒体抗体、抗肝溶质抗原I型抗体、抗SP100抗体、抗gp210抗体、抗Ro-52抗体和抗着丝点抗体)。
急性肝炎主要因病毒感染所致,常见的病毒种类为乙肝病毒和丙肝病毒等。慢性肝炎为肝组织发生炎症反应及肝细胞坏死持续6个月以上,伴不同程度的肝纤维化,包括病毒性肝炎、自身免疫性肝炎和慢性药物性肝炎等。在正常情况下,GGT/ALT比值为1.53,各型肝炎均小于1[1]。本患者GGT的平均值/ALT的平均值为5.01,不符合急慢性肝炎的诊断。
肝硬化是一种或多种病因长期或反复作用于肝脏引起,以肝组织弥散性纤维化、再生结节和假小叶形成为特征的慢性肝病,以肝功能损害和门脉高压为主要临床表现,晚期可出现各种并发症,可出现ALB和CHE降低、PT延长等。本患者ALB、CHE和PT结果正常,故可排除肝硬化。
2024年3月14日,患者如约进行了上述检查,我院检验肿瘤标志物均在正常参考范围中,超声显示肝胆脾结构未见异常。
2024年3月18日,金域检验结果显示:ANA着丝点型(1:80)+核膜型(1:80);IgM>5g/L(0.4-2.3),其余Ig和补体结果正常;AFP2.99、AFP-L3<0.6、AFP-L3/AFP<5%,结果正常;IgG4 0.13g/L(≤2g/L)、自身免疫性肝病八项均阴性。
根据我院肿瘤标志物结果和金域肝癌三项结果,排除了原发性肝癌,故诊断疾病的缩小到了自身免疫性肝病的范围。自身免疫性肝病是一组累积肝细胞和/或胆管上皮细胞的自身免疫性疾病,主要包括自身免疫性肝炎(AIH)、原发性胆汁性胆管炎(PBC)、原发性硬化性胆管炎(PSC)和IgG4相关性胆管炎。根据IgG正常,排除AIH[3];由于患者IgG4阴性,故排除IgG4相关性胆管炎。PSC分为大胆管型PSC、小胆管型PSC和PSC-AIH重叠综合征等类型,其诊断标准均包括成人ALP升高、儿童GGT升高的生化改变[4],陈文雅等[5]也分析了PSC的检验指标,ALP中位数为318.3U/L,GGT中位数为200.0U/L。本患者GGT升高的程度远高于ALP,故可排除PSC。
该患者AMA2虽阴性,但其阴性不能作为排除PBC的依据。据报道5%-8%的PBC患者检测AMA为阴性[2],EASL指南认为,生化指标GGT和ALP增高,可作为PBC的诊断线索,在生化证据的基础上,只要病理学证据和免疫学证据中任何一项为阳性,即可诊断PBC。该患者免疫学证据为阴性,但生化证据为阳性,且属于PBC好发人群,因此需要进一步获取组织学证据予以确认,故建议患者到上级医院做肝穿确诊。
AMA为阴性的PBC患者常伴有ANA和/或抗平滑肌抗体阳性,伴胆管损伤,但临床表现、生化检查结果和肝组织病理上很难与AMA阳性的PBC相区别,故被称为“自身免疫性胆管炎”[3]。本患者ANA阳性,IgM升高,符合PBC的特征性表现[6],具有辅助诊断意义[7]。
PBC是一种原因不明的慢性炎症性自身免疫性胆汁淤积性疾病,临床上血清梗阻酶升高,以GGT血症为主,自身抗体AMA或AMA2抗体阳性,严重病例可快速发展为肝硬化或肝衰竭[7]。国外报道PBC的患病率为2/10万-24/10万,我国既往报道PBC少见。本PBC患者AMA阴性伴ANA阳性,实属罕见。所以检验人员要在提高检验质量的同时,积极学习临床知识,提高沟通能力,进一步提高诊疗水平,更好地服务于临床,服务于患者。
参考文献
刘凤奎, 刘贵建. 临床检验与诊断思路 [M]. 北京: 北京科学技术版社, 2008: 22.
王兰兰. 医学检验项目选择与临床应用 [M]. 北京: 人民卫生出版社, 2017: 228-230.
顾兵, 张晓宁, 黄朝晖, 等. 临床检验结果案例解析 [M]. 长沙: 中南大学版社, 2017: 232-234.
杨松, 李玥. 原发性硬化性胆管炎的诊断与鉴别诊断 [J]. 内科理论与实践, 2022(17)1: 24-28.
陈文雅, 张婷, 李梦琪, 等. 原发性硬化性胆管炎的临床特征及诊疗分析[J]. 第十二届发全国疑难及重症肝病大会论文汇编, 2023, 198-199.
陈筱菲, 黄智铭. 消化系统疾病的检验诊断 [M]. 北京: 人民卫生出版社, 2016: 191.
张秀明, 李朝阳. 临床生化检验案例分析 [M]. 北京: 人民卫生出版社, 2023: 80-81.




