临床免疫检测中干扰因素的系统解决方法
【摘要】目前免疫测定由于其完全自动化、快速的周转时间、高特异性和灵敏度的特点,而成为大量复杂且异质性分子检测的首选方法。尽管免疫测定表现出卓越的性能,但它们容易受到多种干扰因素的影响,并可能导致对患者不利的后果(例如,实施不合理的治疗方案、诊断延迟、不必要的侵入性检查)。在临床实验室中倘若进行全面排查定会显著影响预算、周转时间和投入过多的人力资源,因此只能对于某些干扰物质进行有选择的筛查。所以,在面对异常结果时,通常更倾向于采用逐案处理的方法。在此,我们回顾了当前关于免疫测定干扰的知识,并提出了一种从怀疑存在干扰到使用适当测试识别干扰的系统解决办法。我们拟定此种方案,旨在使实验室专家在面对潜在干扰时的处置合理化,并强调他们与临床医生和制造商合作的重要性,以确保未来工作的持续改进。
【关键词】系统的解决方法;免疫测定;干扰;患者照护
目前免疫测定技术由于全自动化的应用、样本周转时间短、高特异性和灵敏度的分析特点,而成为大量复杂且异质性蛋白质分子检测的首选方法。这一突出的优势得益于抗原与相应抗体高特异性和高亲和力的结合。尽管免疫测定表现出诸多的卓越性能,但它们容易受到多种干扰因素的影响,并可能导致对患者不利的后果(例如,实施不合理的治疗方案、诊断延迟、不必要的侵入性检查)。现今,大多数实验室的免疫测定已实现了自动化,基于竞争性(限定试剂检测法)或非竞争性(过量试剂、双位点或夹心法)模式,并涉及多种类型的标记物以进行信号检测(如酶联免疫吸附测定、酶增强免疫测定技术、电化学发光免疫测定、发光氧通道测定)。在竞争法测定中,信号与抗原浓度成反比,而在双位点测定中,信号与抗原浓度正相关。此外,还采用了多种固定化抗体的方法,其中最常用的是生物素-链霉亲和素的相互作用。然而,这些技术容易受到多种因素的干扰,可能会对患者造成有害后果(例如,实施不适当的治疗,延误诊断,不必要的侵入性检查)。在最近的文献复习中发现,估计在心脏或甲状腺检测中至少45-50%的干扰记录导致了误诊和/或不适当的治疗。干扰物表现出多种特性:其浓度可能随时间波动,根据其性质可能导致假阴性或假阳性结果,它们对于个体而言具有针对性,并且通常与特定的分析方法相关。目前,在免疫测定中显示的干扰频率波动在0.4%至4.0%之间。识别干扰仍是一个具有挑战性的过程,通过采取实验全程管理的方法可以得到改善和促进。本综述目的是总结当前关于免疫测定中干扰物的知识,并提出一个实用的系统解决办法,以帮助实验室专业人员和临床医生识别干扰,避免对实验室结果的错误解读。我们将通过介绍所有主要的影响因素来探讨这一系统解决方案,从疑似干扰到应执行的相关测试。
一、系统解决方法
1. 疑似干扰:虽然对每个样本的干扰进行系统的调查将提高其检测准确性,但这种做法在临床实验室中是不切实际的,这将对实验预算、TAT和人力资源带来显著影响。然而,在特定条件下,系统性地探究干扰因素证明可能更具有成本效益(见第3章)。一些侧重于利用患者数据的策略也被提出来以增强其检测性能(例如,贝叶斯统计,患者中位值调查)。但是,这些方法应该被视为一个试行方案,需要进一步验证。在缺乏更好的建议的情况下,目前干扰的识别大多是在逐个案例的基础上进行的。在此,我们提出了一个详细的系统解决办法,旨在处理疑似干扰的案例(图1)。该方法的第一个重要步骤是干扰的怀疑。检测结果与临床表现、病史(包括临床和生物学两方面)以及其他生物学指标测量结果之间存在的不一致性,提示可能存在检测干扰情况。临床医生处于诊断前沿,能及时发现实验室结果与临床表现之间的不一致,并且持续将这些发现通知实验室。临床医生在检测之前(即检测项目申请)也同样起到至关重要的作用,因为他们掌握着每位患者的重要医疗数据,可以通过向实验室提交的申请传达相关信息。另一方面,实验室专业人员和工作人员能够预防一些分析前错误,并将它们与以往实验结果或其他检测指标[如:促甲状腺激素(TSH)、游离甲状腺素(FT4)及/或游离三碘甲状腺原氨酸(FT3)之间的关系;碱性磷酸酶(ALP)、钙和25-羟维生素D(VitD);雄烯二酮、脱氢表雄酮硫酸酯(DHEA-S)及睾酮;心肌肌钙蛋白(cTn)、肌酸激酶和CK-同工酶(CK-MB)]进行对比,进而识别出不一致的结果。在怀疑存在检测干扰之前,考虑使用适当的参考区间(如按年龄、性别区分)及结合具体情况分析[如用药情况、是否空腹、体位(如肾素水平受体位影响)、体力活动(如职业运动员D-二聚体、N末端脑钠肽前体(NT-proBNP)、心肌肌钙蛋白(cTn)水平的升高),以及昼夜节律(如皮质醇、促肾上腺皮质激素(ACTH)、睾酮、促甲状腺激素(TSH)、应激状态下的催乳素(PRL)、生长激素、甲状腺激素等]是至关重要的因素。
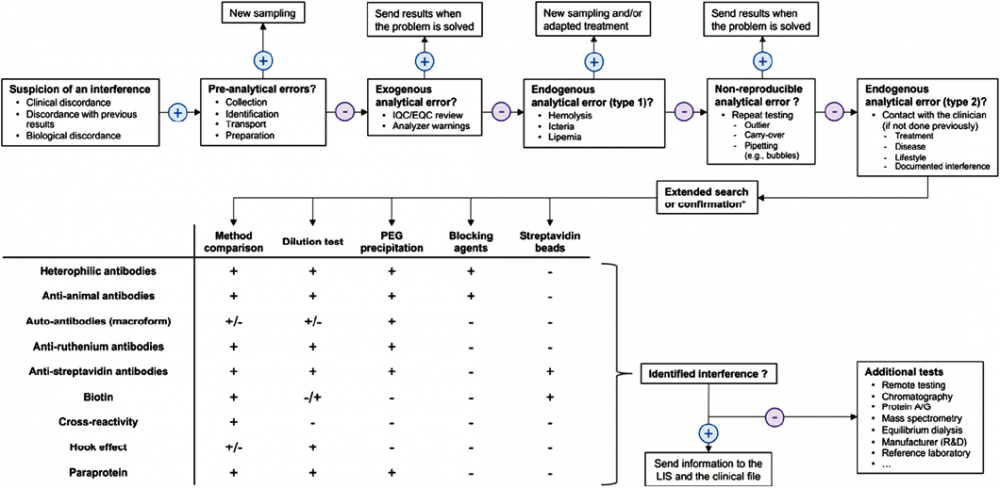
注:EQC,室间质量评价;IQC,室内质量控制;LIS,实验室信息系统;PEG,聚乙二醇。依据临床医生提供的信息,可以优先采取特定方法测试(例如,在使用生物素药物的情况下进行方法比对或链霉亲和素珠处理)。
图中主要英文单词注释:new sampling 重新采样;adapted 适当的 suspicion 怀疑;discordance 不一致;Interference 干扰;previous 先前的;以前的;identification 识别,标识;preparation 准备(工作);exogenous;外因的,外源性的;warnings 发出警告,报警;lipemia 脂血;non-reproducible 不可复制的,不可重复的;Outlier 离群值;异常值;carry-over 遗留物;携带;pipetting 吸量管,移液器或自动化的样本或试剂注射器;bubbles泡(bubble的名词复数);lifestyle 生活方式;documented 备有证明文件的;confirmation 证实;extended search 扩大搜索范围;dilution 稀释剂;precipitation 沉淀;blocking agents 屏蔽试剂 封闭剂;streptavidin beads 链霉亲和素珠;heterophilic 异嗜性的;auto-antibodies 自身抗体;macroform 宏观形式—临床体征和症状;ruthenium 钌;biotin 生物素,维生素;维生素H;paraprotein 异常蛋白,副蛋白;Additional 附加的;remote testing远程的;第三方实验室,远程测试;chromatography 层析法;mass spectrometry 质谱测量,质谱分析;equilibrium dialysis 平衡透析;manufacturer 制造商,制造厂。
图1. 免疫检测中干扰因素调查的实用方法
2. 排除分析前误差:分析前误差是实验室中最常遇到的错误。它们通常分为四类:(1)取样误差(如浅静脉留置针、血样管采集顺序、抗凝剂类型、试管添加剂、混匀),(2)标识错误,(3)运输错误(如稳定性、温度),以及(4)处理错误(如离心、分装)。主要的分析前误差包括:样本识别错误、采样管填充不当、试管选择不合适、样本凝结、检测申请表填写不准确、运输和保存过程中的失误,以及体外溶血现象。这些分析前误差潜在地会对患者照护产生负面影响,并伴有额外的成本负担。因此,在后续寻找其他干扰源之前,应先排除这些影响因素。对此,需要确认患者的身份,检查试管的完整性(例如,检查添加剂情况),并确保遵循实验室操作规范(例如,试管类型、试管充填、是否有凝块)。恰当的样本采集量对于使用柠檬酸作为抗凝剂的分析测试(例如,D-二聚体)尤为重要,必须严格执行以避免出现假阴性结果。尽管大多数检测项目在室温下可稳定数小时,但其中一些项目对运输条件很敏感。例如,推荐使用乙二胺四乙酸(EDTA)(一种钙螯合剂,用以限制酶解作用)作为抗凝剂来测定促肾上腺皮质激素(ACTH)。然而,EDTA和柠檬酸可能通过螯合铕标记物干扰某些检测。锂肝素管通常用于激素的定量分析。如果抽血后试管内样本混匀不充分,残留的纤维蛋白原可能会生成纤维蛋白,从而导致干扰。样本未充分混合也会导致敏感测量指标稳定性下降。另一方面,血清样本因不需要抗凝处理而避免受抗凝剂影响,并且对绝大多数生物测量指标具有良好的稳定性。但是,这类采血管(指不含抗凝剂、用于获取血清的管)在离心前需要一个30分钟到1小时的凝固阶段,以便去除可能干扰分析的纤维蛋白原、纤维蛋白和血细胞,因此会延长整个检测周转时间(TAT)。某些测量指标,如甲状旁腺激素(PTH),在血清中比在EDTA抗凝管中降解得更快。肾素、胰高血糖素和胃泌素也是较为敏感的测量指标。此外,使用分离胶可能会影响某些测量指标的分析,导致这些分析物可能会吸附在分离胶上[例如,苯巴比妥、苯妥英、卡马西平(几小时内)和孕酮(几天内)]。最后,采集时间和从采集地点到实验室的运输条件也是决定检测指标稳定性的关键因素。如果在分析阶段之前发现此类前处理错误,则需要采集新的样本,并对其传输进行监控,以确保分析按时进行。
3. 外源性与内源性分析误差:影响检验的因素通常分为外源性因素或内源性因素。外源性因素与分析程序缺陷相关(例如,校准品或试剂变质、不精确的移液、清洗问题)。这些影响因素应通过检查内部(IQC)和外部质量控制(EQC)的结果以及仔细分析分析仪报警信息来排除。而内源性因素可分为两类:第一类内源性影响因素[例如,溶血、黄疸或脂血(HIL)],这些干扰因素在分析前就可以被检测到;第二类内源性影响因素(例如,异嗜性抗体、生物素、自身抗体),这类干扰因素在分析前阶段很难被发现,即使通过仔细跟踪室内质量控制(IQC)和室间质量评价(EQC)也无法被检测到。免疫测定中可能遇到的各种外源性和内源性干扰因素总结于表1中。尽管通过光谱法测量,现代分析仪对第一类内源性影响因素的检测越来越准确,即便与分光光度法测定相比,免疫测定通常受影响较小,但它们的存在仍然需要给予足够的重视。通常可以应用适当的阈值来检测脂血干扰,并可采取不同方法来排除检测干扰(例如,超离心、高速离心、脂质清除剂)。如果检测到第一类内源性影响因素并且无法消除,则需要重新采集样本。
表1. 免疫分析中的外源性和内源性干扰因素

二、重复测试并与临床医生联系
在就异常结果联系临床医生之前,相同条件下重新进行分析可能会发现不可重复的结果(例如,携带污染、微颗粒、纤维蛋白、未检测到的气泡)。这类不可重现的错误已经报道涉及多个检测指标,包括心肌肌钙蛋白(cTn),并且显示在不同的分析仪之间也存在一定的差异。值得注意的是,这些不可重现的错误很少能通过严格的质量控制监控或分析仪本身的检测来发现。
排除了分析前、外源性、第一类内源性影响因素和不可重现的分析错误后,进一步采取措施前与临床医生沟通是必不可少的。确实,病历中的相关临床信息对于识别第二类内源性影响因素和确定干扰性质非常实用:
1. 交叉反应性物质:类固醇结构(例如,泼尼松龙、螺内酯、氟氢可的松)、成瘾物质(例如,安非他明、鼻腔解充血剂)、肾功能不全(例如,C-末端PTH片段积聚、5-α-四氢皮质醇、卡马西平代谢物)、儿童(例如,VitD C3-差向异构体积聚)、解毒剂(例如,地高辛免疫球蛋白Fab片段)。
2. 免疫接种或自身免疫性疾病(抗动物抗体、异嗜性抗体、自身抗体):治疗用单克隆抗体,与动物接触(例如,兽医、农民、实验室工作人员),病毒或细菌感染,输血,慢性过敏,疫苗接种,类风湿因子阳性的自身免疫疾病,弥漫性红斑狼疮,类风湿性关节炎,桥本氏甲状腺炎,Graves病等。
3. 钩状效应和副蛋白:近期肿瘤疾病的诊断或随访。4. 生物素:食物添加剂摄入、代谢性疾病、多发性硬化症。
5. 载体蛋白:孕妇、避孕药使用者,抗癫痫药物,糖尿病酮症酸中毒或肝素给药(游离脂肪酸的积累改变了甲状腺素与其载体蛋白的结合,可能导致FT4的人为升高)。
6. 其他因素:造影剂,基于血红蛋白的氧载体,等等。
7. 患者病历中提及的干扰因素:值得注意的是,来自母亲的干扰因素可能出现在新生儿身上。如果根据病史无法怀疑存在此类干扰或需要验证,则最终需要进行额外检测以查明干扰原因。
三、其他干扰源的检查与确认
为了识别第二类内源性干扰因素,通常考虑两种情形。第一种是使用相同的互补测试程序,第二种则考虑干扰的特征(即,概率方法)。从临床医生提供的信息可作为重要的参考因素(例如,生物素摄入、泼尼松龙治疗、接触动物,巨分子TSH)。重要的是单一的测试系统很少足以识别干扰。因此,建议应用多种测试平台可以增加识别干扰的机会。在寻找干扰时,建议使用对照患者来判断所见偏差是否确切由干扰造成的。大多数的补充检测操作简单,所需样本体积小,并且可以利用原始样本进行测试。这避免了再次采血。然而,如果剩余体积过小,应联系临床医生考虑重新采集样本。
1. 方法学比对:方法学比对常被视作优先的研究步骤。干扰通常仅限于某些分析方法。因此,可疑的结果应当与不同方法进行比较[例如,不同的抗体固化系统(如,生物素-链霉亲和素)],洗涤次数,患者样本与示踪剂的接触方式(如,一步法与两步法),不同类型的抗体(如,小鼠、绵羊、马),不同的检测系统(如,钌、ALP)等。如果方法选择适当且充分,将有可能识别出大多数的干扰。竞争性免疫测定受抗体特异性不足导致的交叉反应影响最大,这将产生假阳性结果。关于某些药物或激素可能产生的交叉反应的数据在文献中已有报道,而免疫测定试剂的制造商通常会在说明书上提供这类信息。随着时间的推移,实验在减少交叉反应方面取得了一定的进展。例如,氢化可的松免疫测定中泼尼松龙的交叉反应性,在使用罗氏诊断(Roche Diagnostics,瑞士巴塞尔)平台测试时,已经从171%降低到了8%。最近一项文献综述阐明了多种药物及其代谢物对免疫测定的影响。治疗性和免疫抑制剂的药物学监测在免疫测定中常常且主要易受到交叉反应的影响,这主要归因于药物代谢物或内源性化合物的干扰,由此可能会对患者治疗产生重大误导(例如,可能导致药物浓度的虚假升高)。异嗜性抗体、钩状效应(HIL)或副蛋白也可能在某些检测中产生影响。尽管由于检测周转时间更短和基础成本较低,免疫测定法被广泛应用,但液相色谱联用(串联)质谱分析仍然是治疗药物和免疫抑制剂监测的金标准,因为它几乎不受干扰因素影响。
如果在使用钌作为检测系统或生物素作为固化系统的方法时,怀疑存在钌标记物抗体或生物素干扰,建议选择不同原理的测试方法。为了正确判读可能存在的干扰,应明确两个分析仪之间的平均偏差。如果可能的话,应优先选择参考方法,比如平衡透析(例如,测试FT4、睾酮)或质谱法(例如,测试类固醇、治疗监测、毒性物质)。副蛋白干扰通常具有方法学特异性,因此,可疑结果也可以通过与其他方法进行比对来识别。 两个测试系统之间结果的显著差异通常证实了干扰的存在,但并不能明确干扰类型。因此,应采用补充检测方法。此外,方法学比较并不能完全有效识别自身抗体(或大分子复合物)。且常常需要将样本的一部分送至其他实验室进行检测。
2. 稀释试验:在没有干扰的情况下,样品经过梯度稀释,被测量物的浓度呈现线性关系。而当存在干扰时,常常导致线性关系的丧失。经典做法是进行1/2、1/4和1/8的稀释,并且尽可能使用制造商提供的稀释液。线性特征不应通过目测判断,而应考虑更客观的选项,包括仪器测量指标的变异系数。也建议对照样本和患者样本平行测试。稀释试验对于识别来自异嗜性抗体、抗动物抗体、抗钌标记抗体、抗链霉亲和素抗体及副蛋白的干扰尤为明显。
使用稀释方法测试相当简单且快速,但也具有一定缺点。连续稀释后的线性结果不一定表明没有干扰存在,这与Lauro等人提出的解决方法不同。Ismail等人研究显示,在已知含有干扰抗体的样本中,有多达40%的稀释试验后显示出良好的线性。而线性丧失也可能是某些方法学所特有的。此外,这种稀释测试在识别由大分子干扰物或交叉反应引起的干扰并不是非常有效。用于鉴定生物素的稀释测试研究很少,且有更好的解决方案。而且,游离激素(例如,游离T4、游离T3)不能被稀释,除非经过特定验证的条件下,因为稀释会破坏与相关载体蛋白之间的平衡。
然而,稀释试验却是识别钩状效应的首选方法,通常采用逐步稀释(例如,1/100、1/1,000)的方式。钩状效应影响多出现在异常高浓度的测量指标[例如,甲胎蛋白、癌胚抗原、糖类抗原125、前列腺特异性抗原、β-人绒毛膜促性腺激素(hCG)、κ/λ自由轻链、PRL、Tg、铁蛋白、GH、尿白蛋白],以及/或者当试剂盒中使用的抗体量较低时钩状效应几乎完全发生在一步“夹心”法中(即,捕获抗体和检测抗体同时添加)。过量的被测量物会饱和捕获抗体和检测抗体,阻止“夹心”结构的形成。在清洗过程中,只能形成有限数量的“夹心”复合物,产生的信号与正常情况比减弱,导致测量结果表现为低浓度或中等偏高浓度。供应商一般会提供钩状效应阈值浓度,低于该浓度未见到钩状效应。先将样品与捕获抗体孵育,然后在洗涤步骤后加入检测抗体,也可防止钩状效应。
3. PEG沉淀:聚乙二醇(Polyethylene glycol,PEG)6000的作用类似于海绵,能捕获蛋白质结构中的水分,从而改变它们的溶解度并导致其沉淀出来。高分子量的蛋白质相比于低分子量的蛋白质具有更低的溶解度。样本处理采用PEG6000(25%w/w)是一种经典方法,用于识别自身抗体(大分子形式)的存在,但通常也用于判断抗体是否为干扰源(例如,抗链霉亲和素抗体、抗钌标记抗体或副蛋白)。由于特异性不足(例如,螺内酯、泼尼松龙)或钩状效应(例如,在高浓度下的肿瘤标志物),PEG无法识别生物素带来的干扰。
众所周知,巨分子催乳素(macroPRL)是由催乳素(PRL)与免疫球蛋白[主要是免疫球蛋白G(IgG)]形成的一种大分子复合物。这种复合物通常不活跃,机体清除率较低,因此可以在循环中积累。在正常机体中,单体、二聚体(或称为大催乳素)和macroPRL(称为巨催乳素)形式的比例分别约为86%、9%和5%。而巨泌乳素血症为个体血清中巨泌乳素水平占主要成分。目前市售试剂盒所使用的抗体无法区分PRL的单体形式和巨泌乳素。因此会出现假性高值结果。巨泌乳素在普通人群中的患病率约为4%。在高泌乳素血症患者中,其患病率在4%至46%之间。并且最近报道表明其具有明显的地理变异。
4. 其他巨分子形式的物质有:巨钴胺(macroB12)[占钴胺(B12)>1,476pmol/L病例的18%],巨促甲状腺素(macroTSH)[占促甲状腺素升高病例的0.6%至1.6%),或心脏巨分子肌钙蛋白(macrocTn)(占心肌肌钙蛋白(cTn)升高病例的5%,更多地影响cTnI而非cTnT]。尽管某些检测系统对某些巨分子形式的存在不太敏感,但没有一个检测系统是零敏感的。因此方法学比较并不能解决所有问题。建议使用针对PEG处理后的参考值。这些参考值应由实验室专业人员确定,或可在文献中找到。计算回收率(PEG前结果/PEG后结果;%)不再被推荐,因为它可能会掩盖巨分子的存在。当遇到高浓度的球蛋白时,单体形式的共沉淀可能会令人误认为巨泌乳素血症。聚乙二醇(PEG)也可能干扰某些检测平台(例如,化学发光免疫分析系统(西门子医疗保健公司,德国埃尔朗根),Access(贝克曼库尔特公司,美国布雷亚))。聚乙二醇对免疫球蛋白A(IgA)的沉淀效果不佳,因此可能无法沉淀由IgA组成的巨泌乳素。因此,建议使用凝胶排阻色谱法(GEC)来确认巨泌乳素的存在。另外一项研究显示,聚乙二醇(PEG)沉淀还能干扰某些抗生素的定量检测。因此,基于以上多方面的考虑,当检测血清中的抗体时[例如,抗甲状腺过氧化物酶(TPO)、抗甲状腺球蛋白(Tg)],应禁用PEG。
最近,自动化PEG处理的可行性,加上高通量测试程序的可获得性,以及PEG处理后测量指标参考值的应用,使得巨分子物质捕获处理的广泛使用成为可能。
5. 阻断剂:异嗜性抗体是在免疫反应早期形成的低亲和力多特异性抗体,针对抗原表位不明确。主要包括了类风湿因子。抗动物抗体是单特异性、高亲和力的抗体,可识别动物的抗原表位(如马、山羊、绵羊,更常见的是鼠)。因此,在没有动物抗原暴露的证据时(例如,单克隆抗体疗法、与动物的密切接触),应当考虑“异嗜性抗体”的存在。唯有那些高滴度且对检测用抗体具有高度亲和力的抗体,才会引发错误的检测数据并可能导致不利的临床后果。
产生的干扰类型对于异嗜性抗体和抗动物抗体是相同的。在夹心法测定中,假阳性结果更常见,其中干扰抗体充当捕获抗体和检测抗体之间的桥梁。据估计,异嗜性抗体和抗动物抗体的发生率为0.05%--6%,具体取决于测量指标和研究目的。低浓度的类风湿因子存在于大约5%的人群中,以及约70%的类风湿关节炎患者中。
这些干扰性抗体的存在已被广泛报道,涉及多种测量指标(例如,cTn、TSH、胰岛素、D-二聚体、AFP、BNP、hCG、GH、环孢素、他克莫司、人类免疫缺陷病毒)。针对异嗜性抗体和抗动物抗体相关的干扰问题,制造商试图通过在试剂盒中添加阻断剂来消除干扰。选用Fab或F(ab’)2片段而非完整的免疫球蛋白作为捕获和检测抗体,能够避免由抗体Fc段引起的特定干扰。另一种对策是选择带有动物可变区的嵌合抗体。但这种方法并非完全奏效。针对这类干扰,使用阻断剂是一种简便的解决办法。鉴于研究报道具有更高的检测效率,故此推荐使用非免疫血清。阻断剂由中和内源性抗体的免疫球蛋白混合物组成。现存几种市售试剂可供选择应用[例如,异嗜性阻断管(HBT)(Scantibodies实验室公司,美国圣迭戈市),HeteroBlock(Omega生物制品公司,美国博兹曼市),MAB33(单克隆小鼠IgG1)]。如果治疗后有显著变化表明存在干扰。然而,在20%-30%的干扰案例中,经过阻断处理后观察不到任何变化。增加阻断剂的浓度同时保持样本量不变,在某些情况下可以识别出高滴度的干扰物质。据制造商所述,HBT在对抗人抗鼠抗体(HAMA)干扰方面的表现较差。尽管有两篇论文显示,由于抗链霉亲和素抗体和副蛋白引起的干扰可以通过使用阻断剂得到缓解,但这些阻断剂大多无法有效证明异嗜性抗体或抗动物抗体的存在。
四、生物素/抗链霉亲和素抗体的中和
生物素(也称为维生素B7或维生素H)是一种参与脂肪、蛋白质和碳水化合物代谢的重要辅酶。生物素与链霉亲和素一起,常用作免疫测定中的固定化系统。摄入低浓度的生物素,相当于每日剂量为30-35微克,不会干扰免疫测定。然而,用于美容目的(例如,头发、指甲、皮肤;5-10毫克)或治疗目的(例如,代谢性疾病、某些多发性硬化症;高达300毫克/天)的更高剂量生物素可能产生干扰。在夹心式免疫测定中,会出现假阴性结果(例如,促甲状腺激素TSH、心肌肌钙蛋白cTn、前列腺特异性抗原PSA、乙型肝炎表面抗体),而竞争性免疫测定则会出现假阳性结果(例如,游离甲状腺素FT4、睾酮、总乙型肝炎核心抗体、乙型肝炎抗体)。研究显示,美国居民中每日生物素摄入量至少达到1毫克的占比从1999年的0.09%增加到了2016年的2.6%。另一项研究指出,大约15%到20%的美国人使用了生物素补充剂。此外,还观察到在美国急诊科就诊的患者中有7.4%呈现出足以引起干扰的高生物素浓度(≥10微克/升)。因此,这可能令使用对生物素敏感方法的实验室产生诸多担忧。然而,一项针对572名需要监护的重症心脏病患者研究显示,测得的生物素浓度并不足以干扰心肌肌钙蛋白(cTn)检测,而其他研究则报告说,生物素摄入量不太可能对疑似急性心肌梗死患者的cTnT检测产生假阳性结果。在这类患者中,第99百分位的生物素浓度为2.63μg/L。另一项包括1,487名孕妇样本的研究显示,只有3%的样本中生物素浓度超过1.0μg/L,而测得的最大浓度远低于罗氏公司报告的干扰阈值(70μg/L)。以下几种方法可用来识别/中和这种干扰:
1. 查阅患者的病历或询问患者本人:此方法一般情况下不适用,因为患者通常不会主动报告摄入高剂量生物素。
2. 通过微生物学方法、酶联免疫吸附测定、液相色谱串联质谱或快速定性方法[例如,VeraTest Biotin(Veravas,美国奥斯汀)]来测定生物素浓度。然而,这些方法并很难常规开展应用且可能相当昂贵。此外,它们之间缺乏标准化,导致无法应用相同的阈值来判断何时应怀疑存在干扰问题。将样品与链霉亲和素珠混合,生物素会过量地与珠上的链霉亲和素结合。因此,通过离心或磁微粒去除珠子后,此种测量方法将克服生物素的干扰。并对待测测量物的影响相当小(即,大部分<10%)。
3. 等待患者通过肾脏途径排出生物素后再进行测试:通常,24小时的时间足以消除体内的生物素。然而,一些肾功能衰竭的患者可能需要更长的清除期。这也意味着患者管理的延迟以及需要中断几天生物素的摄入(例如,对于代谢性疾病的治疗,但不是理想的方法)。
4. 使用对生物素不敏感的方法(例如,雅培公司的Architect平台)对样本进行检测:罗氏诊断正在研发新一代的免疫测定技术,该测试方法对生物素的抵抗性更强。初期数据显示,在生物素浓度达到1,200μg/L时,对cTn(心肌肌钙蛋白)和TSH(促甲状腺激素)的检测未发现干扰现象。同时,也证明了新一代的Tg(甲状腺球蛋白)检测在生物素浓度高达1,560μg/L时依然不受影响。在图2中,我们针对罗氏诊断(Roche Diagnostics)之前和新一代的NT-proBNP检测进行了生物素添加实验(图2)。纳入了五名患者,他们的NT-proBNP浓度各不相同,并且基于Trambas等人提供的程序,向样本中加入了5个不同浓度的生物素(91、495、824、1,200和3,500μg/L)。新一代检测方法对于高达3,500μg/L浓度的生物素显示不敏感。使用上一代产品时,从495μg/L开始观察到NT-proBNP显著降低。显然,使用不敏感的检测方法是克服生物素干扰的最佳解决方案。
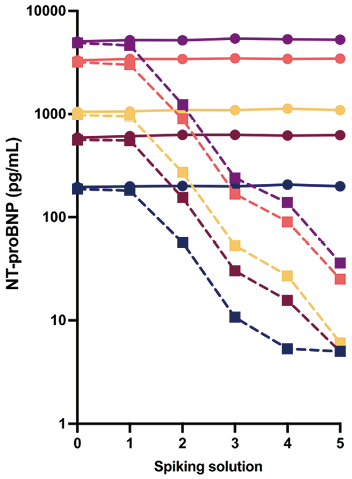
注:虚线代表前一代检测系统,实线代表新一代检测系统。每种颜色表示不同的患者。添加的生物素浓度如下:1=91μg/L;2=495μg/L;3=824μg/L;4=1,200μg/L;5=3,500μg/L。NT-proBNP,N端脑钠肽前体。
图2. 生物素添加对前一代和新一代罗氏Elecsys NT-proBNP检测的影响
2013年首次报道,抗链霉亲和素抗体[免疫球蛋白M(IgM)或IgG],引起的干扰与生物素相似:对于夹心法易出现假阴性结果,而对于竞争性法则易出现假阳性结果。它们发生频率估计为0.6%。大多数已报告的案例都是关于甲状腺功能测试的,也见于对其他测量指标干扰的报道(例如,皮质醇、睾酮、DHEA-S、抗-Tg、抗-TPO)。但它们的干扰来源仍然未知。有学者提出针对普遍存在链霉菌亲和素的免疫反应假说[。对于含有抗霉球菌亲和素抗体的样本,采用不敏感方法的测定或使用链球菌亲和素珠处理是有效克服干扰的方法。对于抗体而言,观察机体代谢清除期并未见效,尽管它们的滴度似乎会随时间延长而下降。已证明使用PEG6000处理能有效沉淀抗链霉菌亲和素抗体。有些治疗是长期进行的(例如,肝素、生物素),况且为规避干扰检测而中断治疗不能随时实施。如果过去已报告了干扰情况,并且观察到相同的干扰模式,那么干扰物很可能同前(例如,抗体、长期生物素治疗)。在这种情况下,合适的方法是应用过去识别干扰的办法来确认干扰物。为了确认副蛋白的存在,可以使用蛋白质电泳和免疫固定技术,或者应用乙醇沉淀干扰物。在某些情况下,也可以测量尿液中的副蛋白以确定结果是否与血液检测一致。例如,如果假设血液样本中的hCG水平有误,阴性的尿液检测可能有助于确认血液中的干扰。这是因为抗体(例如,异嗜性抗体)不会进入尿液中。干扰性抗体可以通过蛋白质A或G处理后有效地排除掉。它与PEG相比,这种方法具有更高的特异性。GEC仍然是检测巨分子物质的参考方法。然而,在某些情况下,巨分子物质的干扰与动物抗体的影响之间很难区分,因为它们展现出相似的色谱图模式并且都对聚乙二醇(PEG)处理敏感。为了将它们区分开来,有人建议将可疑样品与含有高浓度测量物(例如,高促甲状腺激素[TSH])的对照样品(按照1:1的比例孵育4小时)共同孵育。在4小时的孵育后低回收率将更有利于证实巨分子物质的存在。基因分析也能识别出某些导致载体蛋白结合改变的变异体(例如,FT4人为增高)。
在检测中一旦发现干扰,应记录在患者的病历中和实验室计算机系统里,以便预测未来可能发生的干扰,从而提高检测效率。如果尽管强烈的怀疑并进行了多次补充测试,仍未发现干扰,可以将样本送至参考实验室。将样本发送给制造商也是值得考虑的,因为制造商通常拥有实施更复杂的测试资源。
五、干扰的系统性检查
如前所述,对每个患者样本进行全面的干扰检查几乎是不可能的。然而,在某些特定情况下,必须考虑进行系统性检查。实验室人员需与临床医生合作,共同确定方法是否具有成本效益。这对于现已成功地整合在自动化平台上的I型内源性干扰的检测尤为重要。因此,拒收不合格的样本(例如,错误的标识、错误的试管、错误的申请)对于避免某些干扰的发生是至关重要的。临床上自身抗体检测也被广泛实施。鉴于其较高的阳性率(即,在一般人群中占10%,在分化型甲状腺癌病例中高达25%),故此抗-Tg抗体经常与Tg一起测量。对任何催乳素水平升高的个体使用PEG6000沉淀法检查巨催乳素血症也被广泛应用。有人建议在TSH>10mU/L且游离FT4正常的情况下检查巨TSH。最近,鉴于巨B12高发生率(例如,B12>1,476 pmol/L时为18%),我们提议在B12显著升高时实施系统地检测,针对某些关键测量指标,超过特定阈值的样本也通过稀释对钩状效应进行了系统化检查。
如前所述生物素干扰的例子,体外诊断公司正致力于解决常见的干扰问题。临床实验室中干扰物的发现与上报以及与生产厂商的沟通对于推动实验的改进极为关键。但鉴于免疫测定法的技术限制,一个确切的预见性解决方案是采用对特定类型干扰不敏感的检测平台,甚至用质谱技术替代免疫测定技术(例如,类固醇物质、治疗监测、毒理学筛查),可以减少干扰的发生。未来自动化质谱技术的应用因解决检测干扰问题有望成为这一领域的主要检测方法。近年来人工智能领域的快速发展成为了实验室医学领域的热门话题,也可能成为之一的解决方案。周等人最近发表了一种利用深度机器学习的差异分析方法,有效实现了无序混放样本的识别。这一创新举措若能应用于干扰检测,可能会对现存的系统检查方法实现变革,并为自动化干扰分析奠定基础。
最后,提高临床医生和实验室专业人员对这一问题的认识极为重要,因为他们的专业知识加上相关实验程序的应用,可能会促成有效的干扰检查。
结论:问题在实验室医学中是一个至关重要的主题,随着免疫学检测方法的广泛应用,如果干扰不被识别,可能会对患者产生不利的结果。干扰的性质多种多样,其影响也可能因分析方法的不同而异。对于某些干扰,系统性检查已被常规应用,但在许多情况下实施起来仍然具有挑战性。因此,应对具体案例具体分析。为此,根据当前对抗体检测干扰知识的了解,提出了一种系统的解决方案。实验室专业人员和临床医生的经验对于怀疑存在干扰至关重要。这将触发后续的一系列程序,包括在进行广泛检查以识别2型内源性干扰之前,仔细审查分析前的、外源性或1型内源性干扰因素,这种系统性检查结合了多种测试方法。其过程需要很多的时间和人力资源,检测技术的进步和自动化将有助于提高工作效率。因此,提出该系统的解决方法以支持并推动临床工作进一步发展。通过妥善处理干扰来避免影响患者的诊疗尤为重要,实验室专业人员、临床医生和体外诊断设备制造商之间的合作对于确保未来的实验改进是必不可少的。
本文编译自:Clin Chem Lab Med, 2022; 60(6): 808-820




