乳糜泻的实验室检测中临床和方法学方面的考虑因素
【摘要】乳糜泻(CeD)的发病率估计为1%-3%,典型的临床表现是吸收不良,但现在患者可能会出现更隐蔽的症状,如便秘、骨质疏松症或缺铁性贫血,儿童也可能表现为发育不良。CeD具有很强的遗传成分,高危人群包括患有CeD的一级亲属、合并自身免疫性疾病的患者以及染色体畸变的患者。 CeD的诊断检测包括十二指肠组织学、血清学和基因检测。十二指肠组织学历来是诊断的金标准,然而,血清学检测尤其是组织转谷氨酰胺酶抗体-IgA(TTG-IgA)已得到广泛应用,诊断算法主要基于TTG-IgA作为起点。人类白细胞抗原(HLA)分型也可以用于确定CeD的遗传风险。儿童指南支持提供高水平的TTG-IgA来避免活检,其诊断准确性与十二指肠活检相当。可以通过在单独的血液样本中鉴定肌内膜抗体-IgA来进行确认。TTG-IgA阳性水平低和IgA缺乏症的患者需要进行活检才能确诊CeD。CeD的临床随访通常包括重复TTG-IgA 检查。在成人中,痊愈可能会延迟或不完全,难治性CeD的一个罕见后果是转变为肠道T细胞淋巴瘤。尤其是TTG-IgA在诊断中起着核心作用,其准确性可与组织学相媲美,利用实验室检测的诊断算法对于开发改善诊断的新策略至关重要。
乳糜泻(Celiac disease,CeD)是一种主要影响小肠的慢性疾病,它以前主要被认为是一种罕见的婴幼儿疾病,但现在已被认为是一种常见疾病,可发生于任何年龄,在成人和儿童中的发病率为1%-3%,这种高发病率意味着相当多有症状或无症状的人都可能需要接受CeD检测。CeD的诊断由四个部分组成:症状、人类白细胞抗原(HLA)-DQ2/DQ8遗传背景、血清学和十二指肠组织学。对于符合CeD其他诊断标准的一些患者,尤其是儿童和青少年患者,建议省略诊断标准(十二指肠组织学活检)。虽然血清学一直被认为是一种辅助诊断工具,但有证据表明,当抗体水平较高时,血清学可能是一种主要的诊断工具。过去十年中发布的几份临床指南都认识到了从十二指肠组织学到血清学的这一重点变化,而且两者都是质量控制的重点,以提高可靠性和可重复性。本综述的目的是描述CeD诊断和治疗过程中出现的临床和方法学考虑因素。
一、乳糜泻的发病机制
乳糜泻(CeD)是对外源性抗原麸质(麦胶)的慢性免疫反应。来自麸质的醇溶蛋白,特别是来自小麦的,其次是来自黑麦和大麦的醇溶蛋白,在人体胃肠道中很难被酶降解。残余肽具有免疫原性,并通过各种主动和被动过程通过上皮屏障。然后,宿主组织转谷氨酰胺酶与醇溶蛋白片段结合并改变醇溶蛋白片段,现在免疫原性更强的醇溶蛋白肽在HLA-DQ2和/或HLA-DQ8的作用下被肠道免疫系统识别。这些肽被呈递给CD4+T细胞,从而导致进一步的应答,包括细胞毒性T细胞、B细胞活化,随后形成产生针对麸质和组织转谷氨酰胺酶抗体-IgA(TTG-IgA)的浆细胞。B细胞本身可能充当抗原呈递细胞,将对醇溶蛋白和TTG的免疫反应联系在一起。此外,以上皮层为中心的先天性免疫反应会导致细胞损伤,产生IL15,靶向上皮层,使上皮内CD8+T细胞具有细胞毒性。CeD具有自身免疫性疾病的许多特征,如自身抗体形成、特定HLA-DQ单倍型的依赖性、IL-2(白细胞介素-2)、IFNɣ(干扰素γ)和CTLA4(细胞毒性T淋巴细胞相关蛋白4)等免疫因子的基因变异以及先天免疫反应。
胃肠道黏膜的特定组织学变化包括上皮内淋巴细胞增多和绒毛萎缩(图1)。炎症谱被描述为一系列变化,从淋巴细胞浸润表层开始,导致隐窝增生,最终破坏绒毛。Marsh描述的随后被Oberhuber等人扩展为临床病理分类,他们描述了结构的渐进性变化(称为Marsh 3a-3c),Marsh本人并不同意这一修改。醇溶蛋白在肠腔中部分降解,片段通过黏膜,被脱酰胺并与组织转谷氨酰胺酶2(TTG/TG2)交联,然后被抗原呈递细胞(APC)吸收,这一系列事件导致T细胞和B细胞介导的反应
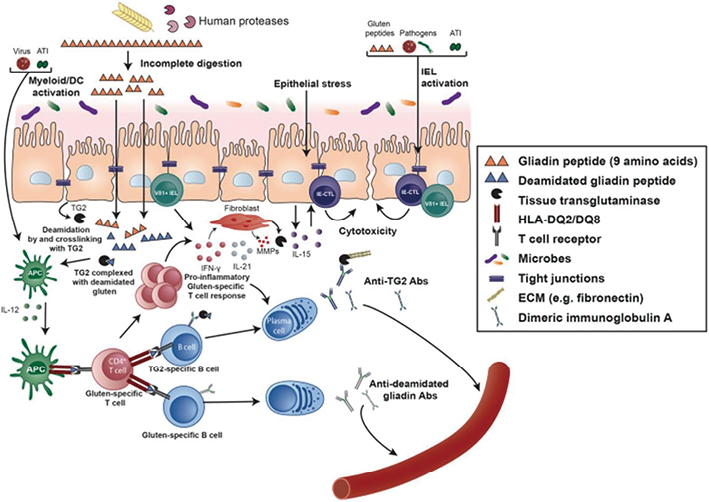
图1. 乳糜泻的发病机制
二、遗传学与风险群体及风险因素
任何年龄阶段都可能被诊断出CeD,但5-8岁是发病高峰期,女性发病率较高,约为60%-70%。遗传学在CeD的病因学中起着重要作用,正如人类双胞胎研究中60%-80%的同卵双胞胎的一致性所证明的那样。大部分遗传性源于HLA-DQ2.5或DQ8的基因型,此外还有许多通过全基因组关联研究发现的与免疫激活相关的基因。不过,HLA基因的作用最为深远,约98%的CeD患者对HLA-DQ2.5、-DQ2.2和-DQ8有很强的遗传依赖性,并导致这些基因型频繁出现的祖先人群中CeD的风险显著增加。在具有北欧血统的人群中,基因型发生率为 20%-40%,相比之下,东亚血统的人群中HLA-DQ2的频率较低(1%-5%),CeD的发病率也较低(0-0.3%)。CeD患者的一级亲属患CeD的风险约为10%-20%(表1)。
表1. 风险因素和相关疾病
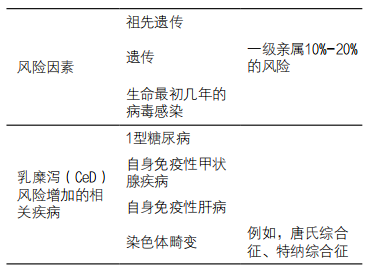
患有其他自身免疫性疾病的患者发生CeD的风险增加,包括(例如)1型糖尿病(CeD的患病率为7%-12%)、自身免疫性甲状腺疾病(5%-10%)和自身免疫性肝病(4%)。长期以来,内分泌学家和胃肠病学家一直在讨论1型糖尿病患者(几乎)无症状CeD的后果,对已经患有糖尿病的患者强制推行无麸质饮食,即使能带来整体临床改善,也会让患者不知所措,然而,糖尿病技术的进步可能会减轻双重患者的治疗负担,并提高人们对无麸质饮食的兴趣。染色体异常如唐氏综合征和特纳综合征也增加了CeD的风险,其发生率为2%-5%,免疫异常可能是由于染色体不稳定所致。此外,IgA缺乏症在CeD中增加2%-7%。当使用TTG-IgA进行血清学筛查时,并发的IgA缺乏症或由其他原因引起的低IgA可能导致筛查过程中的诊断混淆(见下文的进一步讨论)。在CeD检查中可能发现普通变异型免疫球蛋白缺乏症伴IgA缺乏症,并且普通变异型免疫球蛋白缺乏症的组织学改变可能与CeD的改变重叠。除了遗传风险因素外,还有一些环境风险因素被认为会影响罹患CeD的风险。基于人群的研究表明,出生后最初几年的感染,尤其是肠道病毒感染和抗生素的使用,会增加罹患CeD的风险。通过疫苗接种研究,可以获得病毒感染重要性的更多最终证据,接种病毒疫苗可能会降低CeD的发病率,这些研究已经在进行中。
三、临床表现
对有症状CeD可能是一种毁灭性的疾病,它与诊断时的高发病率和死亡率翻倍相关。CeD的直接影响与胃肠道营养吸收不足有关,在极端情况下,这可能导致“CeD危机”,伴有大量腹泻、急性营养缺乏,包括低钙血症、缺铁和代谢性酸中毒。吸收不良通常是逐渐发作的,钙和维生素D缺乏会导致儿童佝偻病和成人骨质疏松症/骨软化症。继发性缺铁性贫血是由于十二指肠对铁的摄取减少引起的。大型人群研究表明,CeD与几种微生物相关,包括某些荚膜微生物感染的风险增加、潜在的脾功能减退、与CeD相关的胃肠道微生物群变化以及艰难梭菌感染的风险增加。成人和儿童最常见的临床表现如图2所示。这表明,从吸收不良到不太明显、更多样和更微妙的表现形式的显著转变。
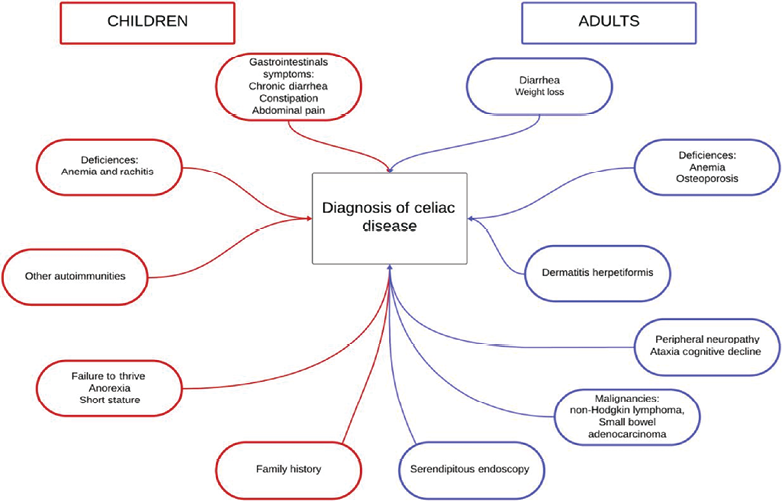
图2. 乳糜泻的临床模式,显示成人和儿童的不同表现
四、难点
未被检出的血清学阳性个体有可能出现不良的健康后果,因此,及时诊断和治疗对控制症状和预防并发症非常重要。爱尔兰的一项研究发现,通过筛查发现的13例CeD患者中,有9例在CeD血清学阳性后的4年评估时间内仍未识别出症状。在芬兰成年人中,对储存的血清进行了2个队列检测,在总共1.05%和1.99%的CeD患者中,1978年-1980年,2/6993(0.02%)有症状,2000年-2001年,32/6402(0.50%)有症状。在老年人中,血清反应呈阳性的CeD与腰椎T值降低和骨质疏松症风险增加有关。这表明,血清反应阳性但未经治疗的CeD患者可能会因持续摄入麸质而导致肠道损伤而累积骨骼变化。尤其重要的是,CeD与淋巴组织增生性疾病之间可能存在关联,淋巴组织增生性癌症在伴有黏膜异常的CeD中增加,强调长期绒毛萎缩的重要性。一旦确诊为CeD,大多数患者都能通过无麸质饮食完全康复,不会出现并发症,然而,多达30%的成年患者会继续出现症状或肠道无法愈合,无麸质饮食给患者及其家庭带来了沉重负担。一部分患者出现并发症,例如难治性CeD、肠病相关T细胞淋巴瘤和胃肠道癌。这些并发症可能与高龄、无麸质饮食依从性差、非反应性CeD、长期绒毛萎缩或诊断延迟有关。
五、诊断选择
CeD的诊断可能基于症状、HLA-DQ2/DQ8、血清学和十二指肠组织学。儿童和成人的症状通常并不精确,经常会怀疑是对含麸质食物的反应。在实践中,症状引导TTG-Ig血清学检测,由于HLA-DQ2/DQ8存在于95%的CeD患者中,但也存在于20%-40%的具有北欧血统的人群中,因此它是一种高度灵敏但特异性低的检测。HLA-DQ2/DQ8检测费用高昂,但随着供应量的增加,价格也有所下降,在已开始无麸质饮食的病例中,HLA-DQ2/DQ8可作为排除CeD的可能诊断,因为无麸质饮食可使血清学和组织学指标恢复正常。十二指肠活检仍被视为参考标准,但有4%-7%的误诊风险。接下来将详细讨论CeD的血清学检测。TTG-IgA检测通常具有优异的性能,灵敏度>90%,特异性>90%,但它本身没有足够的阳性预测值。但是,如果TTG-IgA检测结果大于正常值上限的10倍,并结合第二项检测,如通过直接免疫荧光技术检测EMA(肌内膜抗体-IgA),则诊断价值接近组织活检。事实上,这种顺序检测策略已经得到验证,并在儿童中广泛使用,在无法进行内窥镜检查的情况下,它对成人也可能有足够的诊断准确性。除了在IgA缺乏症的患者中使用脱酰胺醇溶蛋白IgG外,其他血清学检测如脱酰胺醇溶蛋白IgA和IgG抗体的益处通常有限。TTG-IgG只有在患者已知IgA缺乏症时才有帮助,因为在IgA充足的患者中,单独的TTG-IgG假阳性检测很常见,如果存在IgA缺乏症,TTG-IgA检测的效用就会降低。对于已经开始无麸质饮食的患者,CeD检测的诊断价值通常较低,包含CeD多种血清学的检测组合可提高检测的灵敏度,但往往以降低特异性为代价。当CeD筛查试验呈阳性时,在推荐无麸质饮食之前进行确证试验尤为重要。
六、血清学检测
血清学检测的主要用途是初步检测CeD。以前,诊断是基于存在针对未修饰醇溶蛋白的抗体(IgA和/或IgG),通常结合肌内膜抗体的间接免疫荧光检测。EMA-免疫荧光法具有较高的灵敏度和特异性,但对判读人员要求较高,耗时耗力。当TTG被确定为肌内膜自身抗原后,这种情况发生了改变,TTG抗体的固相定量检测方法得以开发,目前已成为CeD检测的主流。市场上充斥着各种制造商生产的检测方法,从手工ELISA到使用荧光或化学发光等作为读数的半自动和全自动酶免疫检测。商业检测法通常具有较高的重现性,但缺乏国际参考物质,意味着使用检测特定的参考区间,并且结果以任意单位报告。当使用合适的参考区间时,大多数检测方法性能良好,灵敏度和特异性超过90%。阳性预测值随抗体水平的增加而增加,当TTG-IgA值大于正常值上限10倍时,阳性预测值达到100%。以这种方式使用检测临界值突出了线性或接近线性在整个检测动态范围内的重要性。2012年,我们与英国国家外部质量评估服务机构合作,研究了各种检测法和实验室的性能(见图3)。这些数据支持对TTG-IgA强阳性(>10倍正常上限)且另一份血液样本中EMA阳性的患者采取避免活检策略。EMA由于其高度特异性,主要用于确诊性CeD试验,由于需要熟练的技术人员,因此实验室中并未广泛使用。如果无法使用EMA,则可使用针对脱酰胺醇溶蛋白肽(DGP)的IgG抗体作为确证检测,不过这种方法的依据有限。
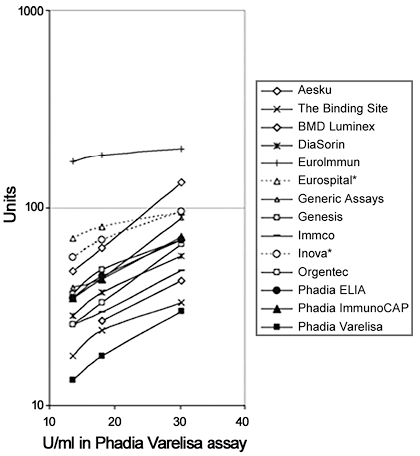
图3. 2012年英国-NEQUAS质量控制服务提供的现有检测方法的检测性能图
欧洲306家临床实验室采用的14种最常用的血清TTG-IgA检测方法的3次阳性检测血清的中位值。即使最初是通过活检进行诊断,也应在患者改变饮食之前使用CeD血清学检测,阳性结果则证实患者的绒毛萎缩是由CeD引起的。为了排除可产生阴性TTG-IgA结果的IgA缺乏症,通常会同时进行总IgA检测,如果IgA水平非常低或无法检测到,则可以进行基于IgG的补充检测(DGP、TTG或肌内膜抗体)。然而,基于IgG的检测还没有像IgA抗体那样进行研究,一些检测方法通过定义一个阈值(如化学发光免疫测定中的相对光单位)来间接推断IgA缺乏症,低于该阈值就可能存在IgA缺乏症。这也适用于其他固相免疫测定,但提示IgA缺乏症的读数仍被认为是不精确的,应通过定量方法(如免疫比浊法)进行确认。目前已有针对TGG-IgA和DGP-IgG的侧向层析床旁检测(POCT),但其有效性仍有待大样本前瞻性研究证实研究。多项研究发现POCT的灵敏度和特异性均较低,POCT可能是一种有用的筛查方法,用于识别未被检出的CeD患者,但缺乏准确性(特别是大量的假阴性结果)降低了POCT在临床实践和人群筛查中的应用价值。
血清学作为乳CeD的诊断工具有几个局限性。首先,检测方法和检测质量之间存在差异,反映在不同的参考范围和检测行为上。其次,由于基于十二指肠活检的诊断具有相当大的不确定性,因此该诊断缺乏真正的“金标准”,这与活检的质量及其解读相关。此外,所谓的证实偏倚可能会夸大血清学诊断的表观敏感性,因为在一些研究中,筛查检验结果会影响验证疾病状态的决定,免疫抑制或感染等生物条件可能会造成假阴性结果。虽然有文献记载,但真正的血清阴性CeD在儿童中并不常见。血清学阳性但十二指肠活检阴性或接近正常的患者可能出现假阳性结果,当检测结果为弱阳性或临界时,这种情况最常见。不过,一些阳性结果(尤其是经EMA证实的结果)可能代表潜在CeD。这通常是无症状的,在一项对儿童进行大约12年随访的研究中,45%的病例发展为明显的疾病,而1/3的病例恢复正常。总之,CeD的正确诊断取决于多种因素,必须结合抗体水平和活检结果来考虑血清学结果。
七、内镜活检(组织学)
内镜活检后进行组织学分析仍然被认为是诊断CeD的参考标准,特别是在没有足够血清学证据的成人和儿童中。自20世纪50年代以来,小肠组织学异常被认为是确诊CeD的依据,十二指肠第二或第三部分活检组织学分析可显示绒毛萎缩和隐窝增生以及上皮内淋巴细胞增多的特征。在不确定的病例中,抗CD3染色可能是确定上皮内淋巴细胞增多的有效辅助方法。也可能固有层普遍扩张并伴有混合炎症细胞类型,虽然这些组织学结果并非CeD所特有,但在大多数西方国家,CeD是最常见的解释。可能会出现不同程度的损伤,有些患者的绒毛完全缺失(即所谓的绒毛完全萎缩),有些患者的绒毛部分充血钝化并出现隐窝增生,还有一些患者的绒毛结构得以保留,但上皮内淋巴细胞增多。最后一种情况通常与CeD无关,而是与感染(如幽门螺杆菌)、药物引起的变化或下游炎症性肠病有关。虽然描述结构变化和炎症通常很简单,但要准确测量这些变化却很困难。通常通过内窥镜获得的组织切片很小,要充分取样和确定切片的方向往往是个难题,这会造成观察者之间的显著差异。样本的准确性还会受到其他组织学变化的负面影响,如Brunner腺体肥大和伴随的消化道变化。最后,一小部分患者(<10%)会出现局限于十二指肠球部的“超短”病变。组织学的不确定性和局限性要求在实施麸质限制之前使用血清学检测来确认CeD。血清阴性应促使寻找组织学变化的其他原因。
八、经验无麸质饮食和其他措施
确定CeD诊断的另一个影响因素是对无麸质饮食的临床反应。CeD患者可能对无麸质饮食至少有部分临床反应,但这种反应不会区分患有和没有CeD的患者。尽管血清学检查结果为阴性(例如,由于过早实施无麸质饮食),但疑似CeD的患者如果没有禁忌证,可以接受麸质摄入挑战。在这种情况下,血清学试验可确定麸质挑战是否持续了足够的时间以引起损伤。然后,在每天摄入3-6g的适量麸质6周后,进行血清学检测。如果血清学从阴性变为阳性,随后的活检会发现损伤。已经在服用无麸质饮食的患者对CeD诊断提出了特别的挑战,他们可能不愿意接受长时间的麸质摄入挑战,这通常会导致显著的症状。如果患者缺乏HLA-DQ2和-DQ8基因型,则HLA基因分型可在很大程度上排除CeD:首先应确定患者具有高危基因型DQ2.5、DQ2.2或DQ8。如前所述,麸质挑战需要足够的剂量和持续时间才能产生明显的组织学变化。有些患者不会出现明显症状,因此建议将血清学作为初步检测,以确定何时安排活检。如果血清学检查结果为阴性,则在进行内镜检查前继续接受6周的挑战。麸质挑战对许多患者来说都不舒服,但通常是安全的。但是,如果报告有麸质暴露的重度症状(如神经系统症状或需要紧急就医的症状)的患者,则不应接受长时间的麸质挑战,在没有其他诊断的情况下,可能应假定其患有CeD。CeD有时在内镜检查中首先被发现,包括环形皱襞消失、剩余皱襞边缘的扇形和裂开或皱襞间黏膜出现马赛克状。沉浸式视图可能缺少绒毛,绒毛通常很容易看到。视频胶囊肠镜也能看到类似的结果,这种检查通常用于不明原因的缺铁性贫血。有时,敏锐的放射科医生会根据横断面成像结果提出诊断建议,经皮超声有时可以显示肠道血流模式增加,这可能提示CeD。总之,对于仍在食用麸质的患者,血清学和组织学(如适用)足以提供CeD的可靠诊断。
九、诊断算法(成人、儿童)
CeD历来主要发生在儿童身上,诊断的主要方法是进行肠道活检,因此,人们逐渐开发出了简化算法。血清学诊断的适用范围越来越广,首先基于IgA醇溶蛋白抗体,然后在发现转谷氨酰胺酶作为CeD的主要抗原后,又增加了TTG-IgA血清学检测方法。由此产生了一些诊断算法,如欧洲儿科胃肠病学、肝脏病学和营养学会(ESPGHAN)的儿童和青少年指南(ESGPHAN 2020)(图4)和针对成人的Oslo诊断标准。尽管在某些方面证据有限,但血清学的优势仍被认可。大多数指南[包括2013年美国胃肠病学会(ACG)指南]包括TTG-IgA测定,但仍然要求对所有病例进行十二指肠活检。然而,ACG指南最近进行了更新,允许儿童和青少年仅依靠血清学进行诊断,而ESPGHAN儿童和青少年指南则进一步发展为仅依靠血清学进行循证诊断。
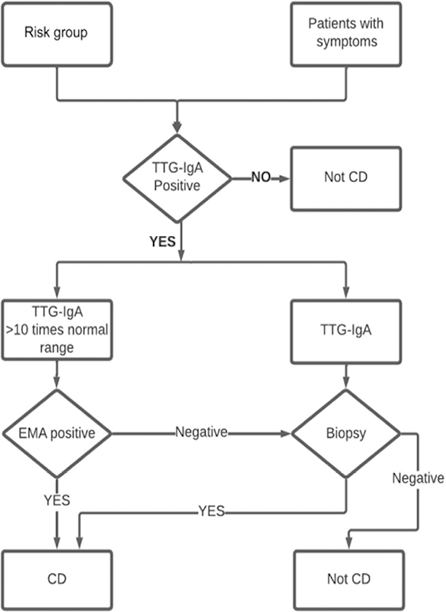
图4. 用于CeD的ESPGHAN 2020算法
可以得出结论,目前的趋势是更加重视血清学分析,成人指南也朝着侵入性较小的诊断方法发展。图5显示了ACG诊断成人和儿童的总体算法。拒绝或被认为不适合进行内镜检查的成人,如果符合与儿童相同的严格血清学检查结果,仍可获得可靠的诊断。
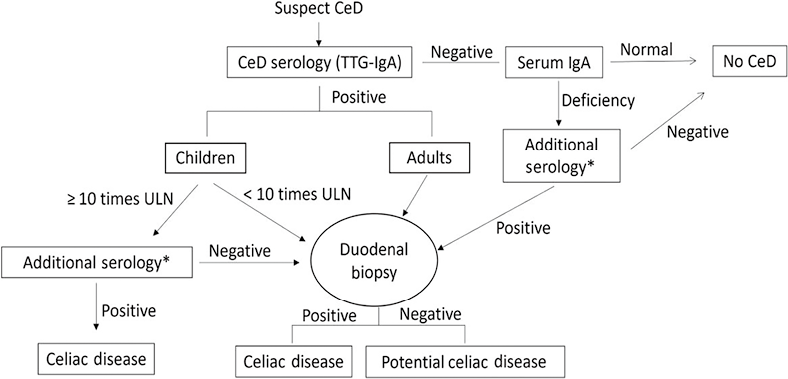
注:*额外的血清学检查,包括肌内膜抗体和脱酰胺醇溶蛋白抗体(IgA或IgG);潜在的CeD是通过血清学阳性和小肠绒毛结构正常来定义的;该算法可能不适合已经遵循无麸质饮食的人。
图5. CeD的组合诊断算法/流程图
十、乳糜泻的随访
尽管无麸质饮食的临床改善是儿科和成人指南的一部分,但仅凭症状改善可能无法准确反映愈合情况。CeD血清学通常用于CeD患者的随访,以证明对无麸质饮食的反应。从诊断到治疗后血清学水平的下降通常伴随着生物学改善。开始无麸质饮食>1年后血清学持续阳性可能提示持续的麸质暴露和肠道损伤,但持续有明显肠道炎症的患者血清反应阴性并不少见。血清学检测的参考范围并非针对疾病管理而设计或优化。在实践中,接受治疗的患者的高负值结果可能表明未能完全治愈。在可能的情况下,重要的是在检测和随访中使用相同的检测方法,以提供可比性。超出检测可测量范围的结果也会使连续检测的准确性降低。
十一、临床意义
CeD在所有年龄段都很常见,表现各异。有许多测试和检测可用于诊断,人们对这些方法的优缺点的普遍认识有限。重要的是,要根据最初的CeD特异性血清学提供可靠、易懂的检测策略,以解决IgA缺乏症,并通过避免包括特异性较低的醇溶蛋白抗体检测panels(如在没有IgA缺乏症的情况下进行TTG-IgG检测)来最大限度地提高特异性。使用广泛panels或联合筛查测试已经让位于提供更合理血清学检测的方法。可能由于缺乏认识,目前诊断CeD的血清学结果不足以保证诊断。终生不含麸质的饮食需要严格的检测。SPGHAN指南中针对儿童和青少年的原则受到了批评,因为该指南规定了10倍的正常临界值上限,以及可以避免在十二指肠活检之前进行第二次血液样本EMA测定和第二次TTG-IgA测定。指南中的这些内容在日常实践中很容易被忽视,从而增加了诊断的不确定性,并对全科医生和公众的教育提出了更高的要求。然而,一旦确诊,无论诊断是基于血清学还是十二指肠活检,坚持无麸质饮食都是可以接受的。
十二、未来方向
血清学在儿童CeD诊断中的有效性使50%的患者无需进行内镜检查就能得到确诊。尽管在疾病表现和诊断模式(包括对癌症监测的担忧)方面存在差异,但预计成人的诊断将遵循相同的路径。通过检测标准化、使用其他特异性抗原和更灵敏的检测方法,血清学的质量可能会进一步提高。尽管在大多数情况下无需立即做出诊断,但仍需开发可靠的POCT。对CeD患者的随访一直被忽视,尤其是成人患者,因此需要优化血清学检测/方案,以便进行随访。随着对疾病发病机制认识的不断深入,我们在诊断和临床方面取得了进展,从而使除无麸质饮食之外的治疗干预成为可能。目前正在进行临床试验,以测试减少或防止麸质对肠道的影响以及麸质进入免疫系统的不同方法。需要准确的生物标志物来识别适合干预的患者并评估治疗反应,因为标准血清学既不能快速反应也对变化特别敏感。组织学在很大程度上是定性的,观察者之间存在显著差异,尽管在研究环境中定量检测是可行的。此外,人工智能(AI)和数字图像分析可为临床病理学家提供定量方法。AI还可以帮助识别提示CeD的内镜特定外观模式,而使用AI分析患者的既往病史可以识别患CeD风险的人,并可能增加临床对CeD可能性的认识。
将HLA分型与其他遗传位点的数据相结合,可以改进疾病的遗传预测,并确定风险评分。一旦有了其他治疗方法,将需要客观的无创工具来选择适合治疗的患者,还需要客观的随访措施。对于已经长期接受无麸质饮食的患者,测定单剂麸质挑战后的细胞因子反应提供了替代麸质挑战的机会,而循环细胞对麸质的基线(甚至在体外)反应可能是有用的指标。一些研究表明,向已经在无麸质饮食的CeD患者提供麸质会导致某些细胞因子在4h内增加,特别是IL-2和IL-8(白细胞介素-2,-8)。更进一步,当无麸质饮食的CeD患者的外周血在体外暴露于醇溶蛋白肽时,现在可以鉴定细胞因子反应,当然,即使在没有CeD的患者中,也必须意识到麸质在外周血中发生的非特异性反应。CeD是一种具有明确外源性抗原(麸质)的慢性炎症性疾病模型,为研究人员和临床医生提供了宝贵的知识。本文从广义上综合了CeD诊断和随访的现状。
编译节选自:Clinical Chemistry. 2024 Oct 3; 70(10): 1208-1219.




