补充生物素对生物素-链霉亲和素结合法进行尿液hCG免疫检测的影响
【摘要】目的 对10名健康的男性受试者接受了为期2周的人绒毛膜促性腺激素(hCG)给药方案,同时补充生物素(20mg/d)或安慰剂,在整个研究过程中收集尿液和血清样本,分析hCG和生物素浓度。方法 使用生物素依赖性免疫测定法检测的血清hCG值和使用非生物素依赖性免疫测定法检测的尿hCG值均升高。在hCG+生物素组中,采用生物素依赖性免疫测定法检测的尿hCG值和生物素水平呈负相关(Spearman r=−0.46,P < 0.0001)。结果 补充生物素后,hCG+生物素组的尿液生物素水平比基线水平提高了500倍,比相应的血清生物素水平提高了29倍。使用生物素依赖性免疫测定时,hCG+安慰剂组71%的尿液样本出现hCG阳性结果(hCG≥5 mIU/mL),而hCG+生物素组仅19%的尿液样本出现阳性结果。结论 在使用生物素-链霉亲和素结合方法的检测中,补充生物素会严重抑制尿hCG值,因此不建议在含有高水平生物素的尿液样本中使用此类检测方法。
人绒毛膜促性腺激素(hCG)是一种主要由女性在妊娠期间产生的肽类激素。然而,hCG与另一种促性腺激素(黄体生成素)的结构相似,使得hCG能够刺激男性睾丸间质细胞产生睾酮。由于这种活性,hCG用作某些性腺功能减退症病例的治疗方法。不幸的是,这种活性也导致男运动员滥用hCG,以在给予外源性睾酮后重建内源性睾酮水平或单独增加睾酮。因此,世界反兴奋剂机构(WADA)、专业体育组织和大学项目将hCG列为男性运动员的违禁物。此外,hCG可以由某些类型的肿瘤内源性产生,许多医学协会的临床实践指南允许其在特定环境中用作肿瘤标志物。因此,反兴奋剂组织必须告知运动员推测的hCG阳性结果(尿液中hCG>5mIU/ml),以便在指控运动员违反反兴奋剂规则之前进行适当的医学评估。
大多数运动反兴奋剂检测是使用质谱法进行的,而hCG分析通常使用自动化临床免疫分析仪进行。WADA指南规定,对于筛查目的,检测方法可以对总hCG或α/β异源二聚体具有特异性,但对于确认程序,检测方法必须对α/β异源二聚体具有特异性。WADA认可的反兴奋剂实验室使用数种免疫分析仪检测hCG,其中一些使用生物素-链霉亲和素结合方法容易受到样本中过量生物素的干扰。过量的生物素及其代谢物会和生物素化抗体竞争与链霉亲和素包被的微粒结合,并严重降低检测的灵敏度。这些检测中的生物素干扰是一个经过充分研究的问题,因为假阴性或假阳性结果严重影响临床。由于这些分析仪进行的大多数临床检测使用血清而不是尿液,因此对尿液样本中生物素干扰的研究要少得多。生物素是一种主要通过尿液排泄的水溶性维生素,而尿液生物素水平远高于血清生物素水平,因此这些检测受到干扰的可能性很高。
生物素或维生素B7是一种辅酶,参与和宏量营养素分解有关的新陈代谢过程。它是人类常规饮食的一部分,也存在于许多非处方补充剂中。即使在非常高的剂量(300mg/d)下生物素补充剂也被认为是安全无毒的,并且在美国很容易作为营养补充剂获得。由于知道生物素很容易获得并且可能被广泛使用,因此运动员可能会使用大剂量的生物素补充剂来掩盖非法的hCG使用。本研究的总体目标是了解生物素补充剂如何影响hCG给药后尿液的hCG检测。主要目标是定量尿液和血清生物素水平,使用生物素依赖性免疫测定法和非生物素依赖性免疫测定法比较hCG+安慰剂组和hCG+生物素组之间的尿液hCG值,并比较尿液和血清hCG值。
一、研究对象与方法
1. 受试者选择:本研究招募了10名18-55岁的健康男性,平均年龄(39±5.0)岁,平均体重(83.6±12.5)kg。所有受试者均未使用其他药物或维生素/补充剂,这些药物或维生素/补充剂会干扰研究数据的收集或解读。受试者被告知不使用任何含有生物素的补充剂,但不给予任何额外的饮食建议。受试者被随机分配到hCG+安慰剂组或hCG+生物素组,并且在整个研究期间不知晓其组别身份。所有受试者均接受了hCG管理。
2. 研究设计:所述研究的给药计划和样本采集时间示意图(见图1)。在开始hCG给药之前,每位受试者进行3次基线尿液采集和2次基线血液采集,间隔至少1周,以确定基线值。第2次基线采集后受试者被要求在研究期间每天早上服用20mg生物素(hCG+生物素组)或适当的安慰剂(hCG+安慰剂组)。第3次基线采集后,所有受试者开始每3-4d皮下注射250µg hCG,持续约2周,总共注射7次。每天收集尿液,并每3-4d收集1次血液,直至研究结束,即最后1次hCG注射后约2周。所有尿液和血液采集均指定24h的采集窗口。在注射日,所有血液和尿液采集均在注射hCG之前进行。通过最终的尿液和血液采集来获取生物素或安慰剂。
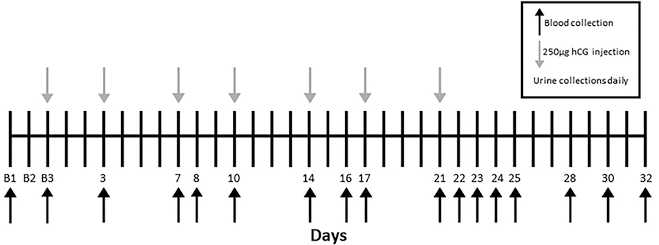
注:在hCG给药开始之前进行了三次基线采集,箭头表示hCG剂量(灰色箭头)和血液采集(黑色箭头)的时间,每天收集尿液
图1. 研究设计示意图
3. 生物素测量:使用内部验证的LC-MS方法对尿液生物素和血清水平进行定量。用Kinetex1.7μm C18 50×2.1mm色谱柱进行色谱分离,以乙腈和0.1%甲酸为流动相。质谱仪在负离子多反应监测模式下运行。生物素的定量离子为m/z 243>166,生物素-d4的为m/z 247>170(内标)。绘制六点标准曲线用于定量分析,尿液值范围10-300ng/ml,血清值范围2.5-50ng/ml。尿液分析时,用水稀释样本20×:在1 ml样本中加入50μg内标(生物素-d4),进样前将50µl的样本/内标物用450µl0.1%甲酸稀释。对于血清分析,用水稀释样本10×,在100μl样本中加入5μg内标,然后,向每个样本中加入500μL乙腈,离心后,干燥300μl上清液,并在进样前用200μl 0.1%甲酸重悬。该方法的尿液动态范围为1-2,000ng/ml,血清动态范围为1.5-50ng/ml。尿液和血清的定量限分别为1.0ng/ml和1.5ng/ml。在3批9次尿液测量中,高(250ng/ml)、中(120ng/ml)和低(30ng/ml)浓度对照的批间和批内CV均<10%,3批9次血清测量的高(15ng/ml)和低(3.7ng/ml)浓度对照的批间和批内CV均<15%。每个批次分别有5个尿液质控(QC)样本(30、120、250、1000和2000ng/mL)和3个血清质控样本(3.7、15和45ng/ml),所有QCs在分析过程中均显示批内CV<20%。
4. 尿液和血清hCG检测:使用A、B公司的分析仪检测尿液和血清中的hCG值,两台分析仪均使用其公司市售试剂盒进行检测。A公司检测试剂盒生物素干扰阈值为1200ng/mL,用于检测完整的hCG。B公司检测试剂盒不使用生物素-链霉亲和素化学试剂,检测总hCG。每批用BioRad的免疫学多项目质控物(Lyphochek Immunology Plus Control)进行分析。A、B公司的方法都不能识别hcgβ核心片段(hCGβcf)。
5. 比重测量:根据厂商的说明,使用Reichert AR200折光仪测量每个尿样的比重(SG),以调整hCG的检出限。根据WADA规范,当SG低于1.018时,检出限为5mIU/mL,当SG高于1.018时,根据公式(1)向上调整检出限,DL是新的检出限:

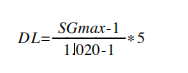 (1)
(1)
SGmax根据公式(2)计算:
SGmax = SGsample+0.002 (2)
6. 数据分析:低于相应检测方法定量限(LOQ)的样本,结果除以√2重新分配检测方法的LOQ值。
7. 统计学分析方法:所有统计分析均使用GraphPad Prism 9软件。在所有线性混合模型分析中,均采用了带有Geisser-Greenhouse校正的混合效应模型。GraphPad Prism 9使用复合对称协方差矩阵,并采用限制最大似然法(REML)进行拟合。对子列因子(受试者)进行匹配,并报告列(生物素或安慰剂)的主效应。由于数据不符合高斯分布,因此选择了非参数Spearman分析进行相关性分析。
二、研究结果
1. 受试者流失和收集依从性:所纳入的10例受试者均完成了研究,包括所有的hCG注射。所有参与者都完成了至少94%的预定尿液采集和至少65%的预定血液采集。参与者中有13%的血液采集完全缺失,主要原因是与研究无关的疾病或假期。
2. 尿液和血清中的生物素水平:hCG+安慰剂组和hCG+生物素组血清和尿液中生物素水平的基线和研究中平均值和范围见表1。开始补充生物素后,hCG+生物素组的尿液生物素平均值增加了500倍,而hCG+安慰剂组的尿液生物素水平没有变化。所有基线样本和hCG+安慰剂组样本的血清生物素值均低于LOQ(1.5ng/ml)。在补充生物素期间,hCG+生物素组的生物素水平范围为29-472ng/ml。
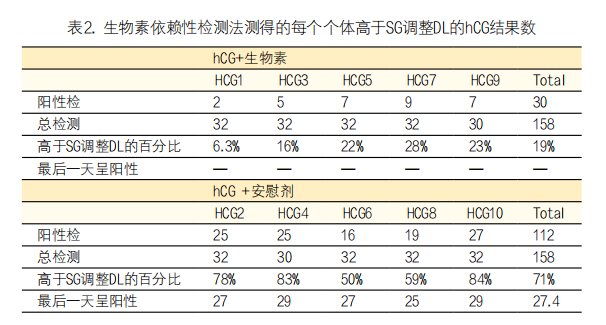
3. A公司尿液hCG检测:所有尿样均用A公司仪器的生物素依赖性免疫测定法进行分析,该方法可定量完整的hCG。图2显示了研究过程中各组的平均值和标准差。hCG+安慰剂组的患者从第1天开始,到第29天左右,返回hCG值均高于基线。在整个研究过程中,hCG+生物素组患者的返回hCG值较低。使用混合效应模型对两组进行统计分析,P值为0.024(见图2)。
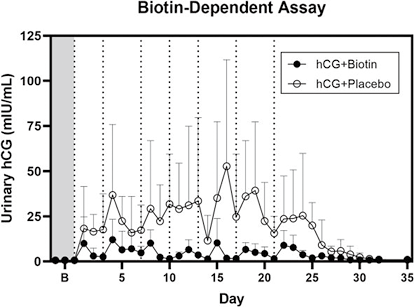
注:阴影灰色区域表示给药前的基线期,虚线垂直线表示给药时间
图2. 用生物素依赖性测定法测量的平均尿hCG值+SD
在表2中显示了除基线采集外,高于SG调整DL的返回hCG值的样本数量。hCG+安慰剂组,71%样本中返回hCG值高于DL;而hCG+生物素组,19%样本中返回hCG值高于DL。hCG+安慰剂组呈阳性的平均最后一天是第27天,即最后一次hCG注射后6天。hCG+生物素组的阳性天数是随机的。Fisher精确检验比较两组返回的阳性结果数量,P<0.0001。
4. B公司尿液hCG检测:所有尿液样本均在B公司仪器上使用不依赖于生物素的测定法进行进一步分析,该测定法可定量总hCG。两组研究过程中的平均值和标准差见图3。hCG+安慰剂组的数值升高与生物素依赖性免疫测定的数值相似。然而,在hCG+生物素组中,结果遵循与hCG+安慰剂组相似的趋势,即hCG给药后hCG值增加。hCG+生物素组和hCG+安慰剂组之间的混合效应模型显示P值为0.27。
5. 血清hCG测量:两组受试者的血清hCG均升高至基线以上,且hCG+生物素组的尿hCG值均高于基线。
6. 尿生物素和hCG相关性:在hCG+生物素组和hCG+安慰剂组中,分别使用非参数Spearman相关性评估测定的hCG浓度和生物素浓度的相关性。在生物素依赖性测定中,hCG+生物素组和hCG+安慰剂组的Spearman r值分别为-0.46(P<0.0001)和0.54(P<0.0001)。在非生物素依赖性检测中,hCG+生物素组和hCG+安慰剂组的Spearman r值分别为0.41(P<0.0001)和0.54(P<0.0001)。
三、分析与讨论
生物素-链霉亲和素依赖性免疫测定中的生物素干扰是血清样本中经过充分研究的现象。然而,尽管有证据表明生物素大量排泄到尿液中,但尿液样本中的生物素却不会产生干扰。在这项研究中,对10名个体进行了hCG对照给药,其中一半人每天服用20mg生物素补充剂,一半人服用安慰剂补充剂。
对所有样本中的血清和尿液生物素水平进行了定量,所有基线生物素测量值均与之前报告的值一致。hCG+生物素组返回尿生物素值比平均基线值高500倍,比A公司生物素依赖性的1200ng/mL 生物素阈值高2.8倍。血清生物素值比尿生物素值低29倍,但仍高于基线。所有血清水平均低于1200ng/mL阈值。使用生物素依赖性免疫测定法对hCG+生物素组和hCG+安慰剂组之间的尿液hCG测量结果进行比较。在hCG+生物素组中观察到尿hCG水平的高度抑制(见图2)。hCG+生物素组中的个体hCG检测呈阳性的概率仅为19%,而hCG+安慰剂组中的个体的hCG检测呈阳性的概率为71%,包括清除阶段(见表2)。当使用不依赖于生物素的测定法检测来自hCG+生物素组的相同样本时,hCG值没有被抑制并且产生与hCG+安慰剂组相似的频率的阳性结果(见图3)。
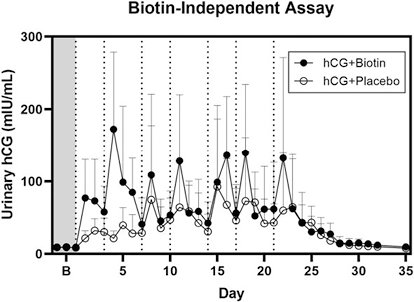
注:阴影灰色区域表示给药前的基线期,虚线垂直线表示给药时间
图3. 用生物素非依赖性测定法测量的平均尿hCG值+SD
由于血清生物素水平远低于尿液生物素水平(见表1),因此使用生物素依赖性免疫测定法对研究当天采集的尿液和血清样本之间的hCG水平进行了比较。对于hCG+安慰剂组,血清和尿液中的值均升高;然而,在hCG+生物素组中,尿hCG水平与血清值相比有所降低,这凸显了补充生物素的个体尿hCG值受到抑制。我们预计此处分析的血清样本中不会出现任何生物素干扰,因为血清生物素水平远低于1200ng/ml试剂盒阈值(见表1)。在不依赖于生物素的总hCG测定中,hCG+生物素组的hCG值似乎略高于hCG+安慰剂组的值(见图3)。仔细观察hCG+生物素组hCG测量结果,有2人的hCG测量值较高;然而,在血清hCG测量中没有观察到相同的人与人之间的差异。因此,我们将此归因于hCG代谢、排泄或尿液中干扰物质的个体生理差异。其中一种物质可能是hCGβcf,已知它会在某些个体的尿液中大量排出,从而错误地降低了一些定量和定性测定中的hCG结果。虽然本研究中使用的A公司和B公司均无法识别hCGβcf片段,并且受高水平hCGβcf的影响最小,但利用先前描述的基于LC-MS的方法进行进一步研究不容易受到这些干扰可以解释这种异常的原因。然而,线性混合模型分析(P=0.27)表明观察到的差异并不显著,可能是由于实验组样本量较小(n=5)。
接下来,评估尿生物素水平和测量的hCG值之间的关系。对于hCG+生物素组,观察到生物素水平与使用生物素依赖性免疫测定法测得的hCG值之间呈负相关,表明较高的生物素水平会导致生物素依赖性测定法对hCG值的更大抑制。对于使用生物素独立免疫测定的hCG+生物素组,存在中度正相关性,可能归因于样本的SG与hCG/生物素值之间的强相关性,因为SG的变化会导致尿液中物质浓度的变化。
对于使用生物素依赖性免疫测定的反兴奋剂检测实验室来说,这些结果表明,在运动员同时使用hCG和生物素补充剂的情况下,仪器检测的假阴性结果的风险会增加。虽然血清样本对这种干扰的敏感性降低,但由于尿液中易于收集、运输过程更简单、成本更低以及检测时间更长,因此,在尿液中进行反兴奋剂hCG检测。用血清检测补充尿液分析可能是有益的,然而,将所有反兴奋剂hCG检测转移到血清目前并不被视为一种实用的替代方案。为减轻生物素干扰,提出了几种解决方案,包括通过链霉亲和素结合珠去除分析前的生物素、稀释样本以及改变服用生物素的个体的样本采集时间。然而,这些替代方案在反兴奋剂应用中都不实用。相反,对于使用生物素-链霉亲和素结合法免疫分析仪的实验室,建议包括监测尿样中的生物素水平、过滤策略或改用不依赖于生物素-链霉亲和素结合法的其他免疫分析仪或方法筛查hCG样本。B公司方法不依赖生物素的检测,然而,在仪器上测定的基线尿hCG值高于在A公司仪器测定的基线值(见图2和图3)。B仪器的返回值约为10mIU/ml,而A仪器的返回值为1mIU/ml。由于WADA目前将hCG的决定限值定义为5 mIU/ml,因此B仪器用于反兴奋剂目的测定尿液中hCG目前是不可行的。一个显著的局限性是生物素补充剂的大剂量(20mg/d)大于大多数非处方生物素补充剂(5-10mg/d),因此,服用生物素补充剂的个体的尿生物素水平可能低于本文报告的数值。无论如何,本文观察到的高生物素水平表明,较低剂量(类似于大多数非处方补充剂)可能会干扰尿液中hCG的测量值。另一个局限是缺乏交叉设计。这将大大有利于研究,让个体作为自己的对照,从而减少观察到的个体间高度差异的影响,建议今后任何此类研究都采用交叉设计。
最后,我们仅研究了补充生物素对hCG检测的影响,然而,生物素依赖性免疫测定法被用于测定几种分析物,这些检测大多用于临床血清样本,在尿液中的任何说明书标示外用药都可能受到补充生物素的影响,如果要使用生物素依赖性免疫测定,应仔细研究对目标分析物和任何潜在的缓和技术的影响严重程度。
四、结论
在使用hCG和20mg/d生物素的男性中,平均尿生物素水平比基线尿值升高500倍,比相应的血清值升高29倍。当使用生物素依赖性免疫测定法时,尿hCG测定值受到严重抑制。但当使用非生物素依赖的免疫测定或相应血清样本时,情况并非如此。这些数据表明,在生物素-链霉亲和素依赖性免疫分析仪中,尿液hCG测定中生物素的干扰远大于血清,这代表了基于尿液的hCG测定的一个严重分析问。
编译节选自:Clinical Chemistry, Volume 69, Issue 7, July 2023, Pages 754-762




