免疫检测中生物化抗体预偶联对减轻生物素干扰的效果与评估
【摘要】目的:确定了3种手工ELISA和2种自动化免疫测定中的生物素干扰。方法:在每次检测中,在加标生物素或加标PBS血清之前向链霉亲和素包被的表面加入生物素化抗体来评估预偶联对减轻生物素干扰的效果。最后,将预偶联法与生物素去除方法进行比较,以比较减轻生物素干扰的效果。结果:在400µg/L生物素存在的情况下,ELISA 测定中分析物检出率减少至总量的10% -15%,自动化夹心(甲状腺球蛋白)免疫测定中检出率减少至15.2%。在自动竞争(游离甲状腺素)免疫测定中,生物素导致检出率增加551.6%。在ELISA检测中,将生物素化捕获抗体预偶联到链霉亲和素表面可使活性回收率达到84%-99%,而生物素去除方案的活性回收率为84%-97%。同样,自动化夹心免疫测定和竞争免疫测定中,预偶联法的回收率分别为97.1%和116.5%,而去除法的回收率分别为95.6%和100.3%。结论:研究展示了如何重新设计检测方法,将生物素化捕获抗体与链霉亲和素预偶联,从而成为生物素去除方法的有效替代方法,以减轻生物素干扰。
【关键词】免疫检测;实验设计;实验室方法
链霉亲和素与生物素的结合是自然界中最强的非共价相互作用之一,因此,已成为临床检测中促进抗体-抗原固定和检测的有用成分。夹心法和竞争法免疫测定中经常使用这种方式,生物素化捕获抗体很容易与固定的链霉亲和素结合,从而促进分析物的固定和检测。然而,当病人样本中存在游离生物素时,生物素与链霉亲和素发生偶联,检测结果就容易受到干扰,可能会分别假性减少或增加夹心法和竞争法免疫检测的结果(见图1)。因此,不正确的检测结果和错误患者分类的风险是重大的临床问题,这促使美国食品药品监督管理局(FDA)于2017年发布安全通报,提醒医生、患者和实验室人员注意生物素干扰的风险。
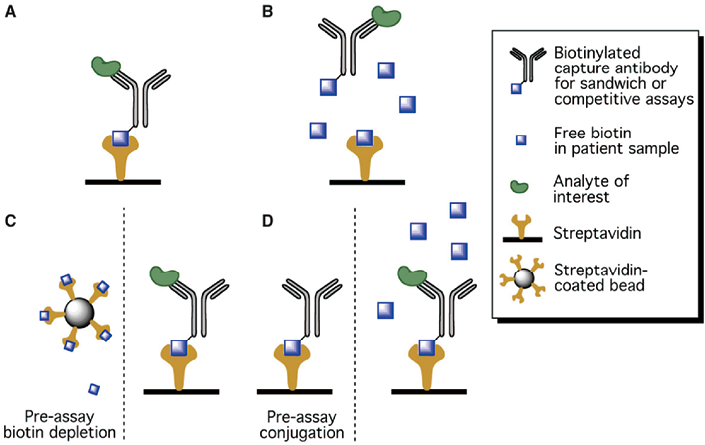
注:(A)在没有生物素干扰的情况下的正常检测;(B)病人样本中的游离生物素会与链霉亲和素表面结合,阻碍生物素化捕获抗体的结合;(C)在分析前去除患者样本中的生物素,以减轻生物素干扰;(D)在加入患者样本前将生物素化捕获抗体预偶联到链霉亲和素表面,从而减轻生物素干扰。
图1. 测试的生物素干扰和缓解方法的示意图
大剂量生物素疗法可用于治疗某些病症,包括多发性硬化症和某些先天性代谢缺陷,但最近的报告显示,大剂量生物素疗法对治疗多发性硬化症的临床疗效有限。每天服用300mg生物素的患者,其血清生物素浓度可达150-700μg/L。此外,服用非处方生物素制剂被吹捧为能促进头发、指甲和皮肤的健康,其普遍使用量也在增加,从而将生物素干扰的风险扩大到普通人群。在一周内每天摄入10mg生物素就会干扰某些免疫测定。2018年美国的一项研究证实,急诊科患者中使用生物素很常见,其中7.4%的患者血清生物素浓度≥10ng/mL,已知这会干扰某些临床检测。由于基于生物素-链霉亲和素的免疫测定法可用于测定多种分析物[例如激素、肿瘤标志物和维生素],因此生物素的消耗增加以及患者样本中产生的游离生物素有导致免疫测定检测错误结果的风险。文献中详细记载了易受游离生物素干扰的测定,以及导致不正确诊断和昂贵或不必要的后续研究的临床结果。AACC关于实验室检测中生物素干扰的指导文件最近纳入了一个表格,其中列出了许多受影响的自动化免疫测定方法。生物素干扰在甲状腺激素测定中尤其成问题,因为接受300mg/d生物素治疗的多发性硬化症患者由于甲状腺激素假性升高而被误诊为Graves病。对其他内分泌测定的干扰包括甲状旁腺激素和睾酮免疫测定,导致服用较低剂量生物素(即5-10mg/d)以促进头发和指甲生长的患者分别被误诊为甲状旁腺功能减退症和睾酮分泌肿瘤。
通过增加实验室和医嘱医生之间的沟通来了解生物素干扰,需要采取持续和多方面的方法。目前的挑战包括及时识别生物素干扰,以免报告不准确的结果。医生可以提醒实验室注意正在接受大剂量治疗的患者,但这种方法在急诊环境中受到限制,因为患者可能不会报告非处方生物素的使用情况。在已知服用生物素的情况下,在采集样本前几天停止服用补充剂可减少生物素干扰,但这同样需要了解补充剂服用、停止服用情况。FDA于2019年更新了一份安全通报,告诫临床医生、患者和实验室人员,并非所有制造商都在努力降低生物素干扰的可能性,自2017年首次通报以来,对患者造成重大伤害的风险仍然令人担忧。不过,在一些制造商正在参与寻找解决方。案例如,Meyer等人通过在检测试剂中加入抗生物素抗体,证明了提高对游离生物素干扰的耐受性。临床和实验室指南针对生物素干扰提出了最佳实践建议,包括系列稀释、避免生物素后重复检测、替代检测方法的使用以及生物素去除方案。
在样本进行免疫测定之前,使用链霉亲和素包被的磁珠去除患者样本中的生物素是有效的,但需要实验室在每次检测中充分验证方案,并需要事先通知接受高剂量生物素治疗的患者,以便对适当的样本进行去除方案。去除法可能会增加检测成本和周转时间,并需要额外的样本处理,这可能会增加出错的风险。一个常见的误解是,所有采用链霉亲和素-生物素偶联的检测都容易受到游离生物素干扰。然而,在蛋白质印迹和自动化免疫测定中,将生物素化抗体与链霉亲和素偶联物预偶联可有效减轻生物素干扰。在本研究中,我们扩展了这一概念,以确定将生物素化抗体预偶联到链霉亲和素表面是否能更广泛地应用于手工酶联免疫吸附试验以及具有夹心法和竞争法免疫测定形式的自动化平台。此外,还试图确定生物素-链霉亲和素预偶联的时间过程、生物素化抗体在链霉亲和素微粒上的稳定性,并直接比较了预偶联方法与已有的生物素去除方法的效果(见图1,C和D)。
一、研究对象和方法
1. 加标生物素:生物素购自Sigma-Aldrich公司。用PBS制备100mg/L生物素原液并储存在-20℃,PBS将原液1:10稀释以形成10mg/L原液,在4℃下储存可达1个月。实验当天,10mg/L原液用PBS配制成10x的新鲜工作溶液,以达到所需的生物素最终浓度(最高1000µg/L)。对照样本用相同体积的加标PBS,以解释稀释和基质效应。生物素浓度的选择符合FDA关于生物素干扰的生产指南,与临床报告的患者样本中的生物素浓度相吻合。
2. 血清样本:之前检测的患者样本被隐去身份信息,合并在一起以进行每个重复测试。通过混合580-980ng/L S100的样本来制备用于S100实验的患者池;混合99-110μg/L神经元特异性烯醇化酶(NSE)的样本制备NSE患者池;2-5ng/ml的患者样本制备细胞角蛋白19片段抗原(CYFRA 21-1)患者池;通过合并甲状腺球蛋白(Tg)抗体筛查阴性且Tg含量为20-29ng/mL的样本来制备Tg实验的患者池;最后,通过混合含有0.8-1.4ng/dL游离甲状腺素(FT4)的患者样本来制备用于FT4实验的患者池。
3. 生物素干扰和预偶联研究(手工检测):为了确定X Ag ®(X替代公司名称)S100、CYFRA21-1和NSE 酶免疫分析(EIA)中生物素干扰的量,在患者池中加标10x生物素,使其最终浓度为100、400或800μg/L或同等体积的PBS(对照)。根据制造商的说明,在X Ag ®检测中对每个样本进行一式两份的分析。根据干扰研究的结果,400μg/L生物素达到接近最大干扰,该浓度用于X Ag ®分析的其余研究,此处和整个过程中使用的“最大干扰”一词的定义是相对于零生物素对照,生物素浓度增加不会导致测得的分析物百分比发生统计学意义上的显著变化。为评估预偶联生物素化捕获抗体以减轻游离生物素干扰的效果,我们进行了时间进程研究。在加标生物素(400µg/L)或加标PBS血清池前0、10、30或60min,向板中加入生物素化抗体。加入生物素化抗体和血清池后,按照生产商的说明进行检测。每个实验包括2个水平在人血清中配制的质控(QC)物。质控物的处理方式与患者样本相同,并进行60min的生物素化抗体预孵育。S100和NSE的质控物来自CanChek Tumor marker。CYFRA21-1 EIA试剂盒包含CYFRA21-1质控物。所有QC结果均通过了使用传统检测形式和60min预偶联技术建立的实验室可接受范围。
4. 生物素干扰和预偶联研究(自动化检测):使用A公司800仪器(A替代公司名称)评估生物素干扰,并对Access Tg检测法和 Access FT4检测法进行预偶联研究。对每种检测方法都校准了新的试剂盒[分析测量范围(AMR):Tg,0.1-500ng/mL;FT4,0.25-6.0ng/dL],并分析了人血清基质中的3个质控水平,以验证可接受的性能。通过分析3个患者池来确定生物素干扰,每个患者池都加标生物素(25、100、400或1000μg/L)或PBS。制备操作试剂盒,用注射器(或吸管)从试剂盒中R1c取出生物素化小鼠抗Tg单克隆抗体或从R1e中取出生物素化小鼠抗T4单克隆抗体。使用另一个注射器从R1a中取出链霉亲和素包被的顺磁株,将取出的抗体和顺磁株放入15mL的试管中,在室温下摇动孵育4h,使生物素化抗体和链霉亲和素磁株预偶联。将等体积的混合物加回试剂盒中的R1c(Tg)或R1e(FT4)和R1a,然后进行新的校准和质控检查。在验证了可接受的QC值后,再次用经过处理的试剂盒检测加标生物素患者池和加标PBS对照。为了评估偶联物的稳定性,将Tg操作盒在仪器上放置25d(在制造商对试剂的稳定性声明范围内),通过倒置混合,并通过3个水平的QC进行评估。
我们进行了方法比较研究,以评估与标准(原始)试剂盒的检测性能相比,操作后的试剂盒的 AMR分析性能。在这些研究中,使用原始试剂和经处理的试剂测量了15个患者样本的AMR。采用加权Deming回归拟合对结果进行比较分析。对低、高质控样本分别进行8次重复测量,评价标准试剂盒和操作后试剂盒的不精密度。
5. 生物素去除研究:从使用B公司免疫分析盒中收集链亲和素包被的磁珠,将0.72mg/ml的磁株悬液集中到50ml锥形管中,4℃保存备用。根据现有方法进行去除研究,简单地说,将1ml链霉亲和素包被的磁株等分到1.5ml的微量离心管中,在每1ml磁株中加入250µl生物素或加标PBS血清池,将样本涡旋混合后在室温摇床上放置45min。然后,将微离心管放入磁力架,将磁株从混合物中分离,一旦在磁铁上形成微粒聚集,就用移液管吸取血清溶液并转移到干净的试管中。生物素池和加标PBS池的对照样本都经过了相同的过程,但未加入链霉亲和素包被的磁株。然后根据制造商的说明对对照样本和生物素去除样本进行分析。
6. 成本分析和统计:于目前的实验室检测和工作流程进行人工成本评估,链亲和素磁株的成本是根据三个不同供应商等效试剂的平均价格估算的。采用配对学生t检验来评估预偶联和去除法之间的统计显著性以及时间进程和生物素剂量评估。图表使用PRISM(Prism软件)生成,R用于加权Deming回归分析,Excel用于成本评估。图1使用ChemBioDraw Ultra绘制。
二、研究结果
初步研究旨在确定X Ag ® S100、CYFRA21-1和NSE EIA中的生物素干扰。每次检测时,血清池中加标生物素浓度从100µg/L到800µg/L,它与FDA制造商指南中推荐的浓度范围一致。在每次检测中都观察到显著的游离生物素干扰。100µg/L浓度的生物素导致CYFRA21-1测量值降低98.1%,S100和NSE测量值分别降低66.9%和34.3%。400µg/L生物素浓度时,在所有3种检测方法中都能观察到生物素的最大干扰,CYFRA21-1、S100和NSE的测量值分别降低了98.6%、91%和86.1%。当生物素增加到800µg/L时,干扰仅略微增大,测量值分别降低了99.2%、95.2%和91.8%(数据未显示)。这些数据证实了在临床相关浓度下这些检测中存在生物素干扰,并提供了评估生物素干扰减轻的平台。使用患者血清池中的400µg/L游离生物素,通过预偶联时间进程以评估游离生物素对S100、CYFRA21-1和NSE测定中的干扰。
时间进程研究表明,加入加标生物素血清之前,当生物素化抗体在链霉亲和素包被的孔中预孵育10min至1h时,所有3种检测的分析回收率均增加(见图2)。在预偶联的30min内,S100、CYFRA和NSE的平均分析回收率[分别为(83.9±2.0)%、(96.9±5.6)%和(86.8±5.7)%]明显高于没有预偶联的情况[(11.5±6.6)%,P<0.01;(15.4±4.5)%,P<0. 01;(9.9±2.2)%,P<0.01],并且3种测定都显示在预孵育1h内生物素干扰最大限度的减轻,分别达到(84.1±3.1)%,P<0.01;(99.2±3.6)%,P<0.01;和(89.5±1.3)%,P<0.001。
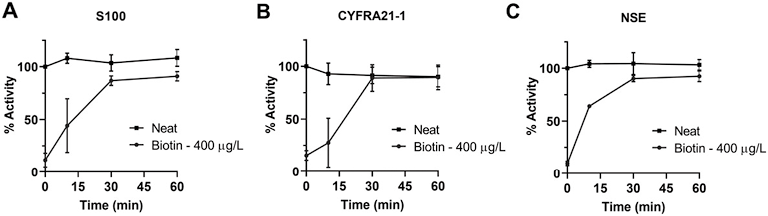
注:在(A)S100、(B)CYFRA21-1和(C)NSE X Ag ®免疫测定中,在加标400µg/L生物素或PBS之前60、30、10或0min添加生物素化捕获抗体。每个时间点的数据表示为加标生物素样本中测量的分析物百分比相对于相应时间点的PBS对照的平均值±SD(n=3)。
图2. 在链霉亲和素包被孔中预孵育生物素化捕获抗体30min,可显著减轻手工ELISA中的生物素干扰
然后,我们将预偶联的有效性与先前描述的通过链霉亲和素包被磁珠预处理去除生物素的方法进行了比较。使用链霉亲和素包被的顺磁性磁株去除加标患者池中的生物素(400µg/L)后,S100、CYFRA和NSE分析的总检测活性回收率[分别为(97.0±1.8)%、(84.1±13.7)%和(95.9±1.8)%]显著高于未去除样本[分别为(9.3±1.2)%、(10.2±2.3)%、P<0.05、(10.4±3.2)%、P<0.01](见图3),在加标400μg/L生物素的样本中,去除法与预偶联法(1h孵育)的直接比较对S100[(97.0±1.8)% vs(84.1±3.1)%,P=0.01]和NSE[(95.9±1.8)% vs(89.5±1.3)%,P=0.01]略显著,但对CYFRA[(84.1±13.7)% vs(99.2±3.6)%,P=0.20]不显著(见图3)。因此,在这些手工操作的夹心法免疫测定中,预偶联在减轻生物素干扰方面的效果与去除法类似。
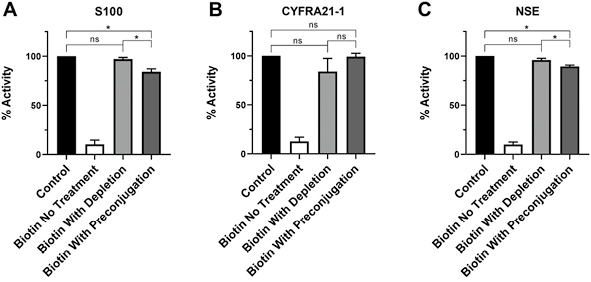
注:患者血清池中加标400µg/L生物素或PBS(对照组),测量S100(A)、CYFRA21-1(B)和NSE(C)的浓度,在生物素存在情况下比较去除法或预偶联法的活性回收率与PBS对照。数据以均数±标准差表示,n=3,*p<0.05,ns:不显著
图3. 在手工ELISA中,在减轻生物素干扰方面预偶联与生物素去除法具有类似的有效性
预偶联的适用性已扩展到自动化平台上的Tg检测。25µg/L、100µg/L、400µg/L和1000µg/L的游离生物素可使Tg回收率分别降至(97.7±1.5)、(80.8±1.0)、(33.4±0.9)和(8.7±0.5)%。然而,在经过操作的(预偶联)试剂盒上分析的4个浓度的生物素,Tg浓度均恢复到与0µg/L生物素对照相似的水平[(98.7±0.9)%,25µg/L时P>0.10;(98.5±3.7)%,100µg/L时P>0.50;(97.1±2.4)%,400µg/L时P>0.10;(96.6±1.0)%,1000µg/L时P<0.05](图4,A)。在自动Tg检测中比较去除法和预偶联法时,两种方法之间没有统计学差异,在游离生物素为400µg/L时,两种方法均能接近总的分析物回收率信号[(95.6±1.6)% vs(97.1±2.4)%,P=0.48)](图4,B)。这一数据证明预偶联也能够减轻A公司自动免疫检测平台上的生物素干扰。
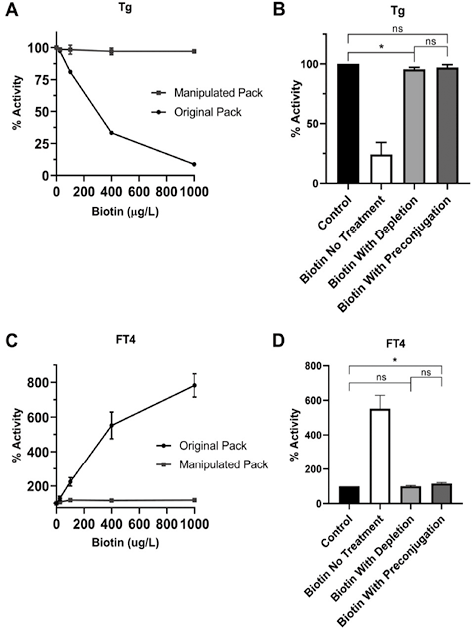
注:血清样本池加标100、400和1000µg/L的生物素,然后在原Tg(A)或FT4(C)试剂盒和经过操作的试剂盒上进行测定。比较使用去除法或预偶联法减少生物素干扰后Tg(B)或FT4(D)分析回收率。数据以均数±标准差表示。n=3。* p<0.05。ns:不显著
图4. 自动化甲状腺球蛋白免疫测定中预偶联法与去除法的比较
除了Tg夹心法免疫分析法之外,还在自动化竞争法免疫分析上进行了上述研究。浓度为25、100、400和1000μg/L的游离生物素分别将FT4回收率假性提高至(128.9±12.9)、(224.1±25)、(551.6±77.4)和(782.3±66.9)%。然而,在操作(预偶联)试剂组上分析的四种生物素浓度中,FT4浓度恢复到更接近0μg/L生物素对照的水平,[(107.7±3.0)%,25μg/L时P=0.05;(118.4±11.2)%,100μg/L时P>0.05;(116.5±5.0)%,400μg/L时P=0.03;(118.9±4.8)%,1000μg/L时P=0.02)](图4,C),这表明生物素干扰大大减少。在FT4自动化检测中比较去除法和预偶联法时,两种方法之间没有统计学差异。与对照相比,当游离生物素浓度为400μg/L时,去除法完全恢复了对照浓度的分析物回收率[(100.3±4.7)% vs(116.5±5.0)%,P=0.05)],而预偶联可将过量的分析回收率部分降低到对照组浓度[(100.3±4.7)% vs(116.5±5.0)%,P=0.05)](图4,D)。这一数据证明,在自动竞争性免疫测定中,预偶联有能力减轻生物素的干扰。
通过检测跨越AMR的15份患者血清样本,比较了标准试剂盒和操作后试剂盒的性能。Tg检测的AMR为0.1-500ng/ml,检测的患者样本范围为2.77-441.38ng/ml。加权Deming回归拟合结果为(Tg操作盒)=0.37+0.88(Tg标准盒),r2=0.998。成人预偶联Tg测定在参考区间下限(1.3ng/ml)和参考区间上限(31.8ng/ml)的绝对偏倚分别为0.2和-3.5ng/ml。FT4 AMR为0.25-6.0ng/dl,检测的患者样本范围为0.3-2.69ng/dl,加权Deming回归拟合为(FT4操作盒)=0.14+1.04(FT4标准盒),r2=0.996。在FT4操作的测定范围内观察到恒定偏倚,平均为0.17±0.04ng/dl。这些初步的相关性研究很有前景,但在Tg测定中观察到的比例偏倚和在FT4测定中观察到的恒定偏倚提示,需要额外努力来调整预偶联的测定校准。比较操作试剂盒、标准试剂盒的检测不精确度。在这些研究中,低值、高值质控样本连续测量了8次,根据8次测量结果计算出CV值。由于试剂盒大小限制,Tg测定的L3不精确性尚未完成。两组不精确度相似(Tg CV:QC1 0.02 vs 0.02;FT4 CV:QC1 0.05 vs 0.03和QC3 0.01 vs 0.03)。最后,评估了Tg试剂盒中生物素-链霉亲和素偶联物在试剂盒有效期(28d稳定性)内的稳定性。抗体与磁珠预偶联25d后,在Tg操作试剂盒上分析3个水平的QC(L1、L2和L3),均在实验室规定的范围内(第0d:10.27、42.73、77.20ng/ml;第25d分别为9.59、42.31、77.07ng/ml),稳定性较好。
我们假设,它与传统的去除法相比,预偶联法具有成本优势。对操作时间进行了评估,发现预偶联法使S100、NSE和CYFRA21-1检测的实验室周转时间分别增加了11%、16%和14%,而去除法使实验室周转时间分别增加了21%、32%和29%。增加的操作时间包括预处理过程中所有移液和转移磁珠、样本和/或试剂的步骤。在移液器上进行的检测(如S100和NSE)可通过编程移取试剂进行预孵育,因此手工时间和相关人工成本不会增加。这与此相反,去除法不宜使用自动移液器,需要增加 150%的手工时间,这意味着S100和NSE每次收费测试的直接成本分别增加了1.16倍和1.06倍。CYFRA21-1在我们实验室完全是手工操作,预偶联法增加了14%的技术时间,使每单位的收费成本增加了1.04倍,而去除法增加了29%的技术时间,使每单位的直接成本增加了1.07倍。此外,试剂成本在去除法中显著较高,我们回顾了多个供应商的链霉亲和素磁珠的成本;每mg磁珠的平均价格是18.87美元。Trambas等表明,在患者样本中,消耗250ng生物素大约需要1.3mg磁珠。因此,用1.3mg的磁珠去除250µL的样本,每个样本的试剂成本增加24.53美元。
三、分析与讨论
本研究扩展了先前的工作,证明了预偶联减轻游离生物素干扰的可行性。工作重点是评估预偶联的时间进程,并将其直接与另一种生物素去除法进行比较。在3种ELISAs和2种自动免疫测定中,我们证明了通过预偶联固定链霉亲和素和生物素化捕获抗体可减少生物素干扰,预偶联显示出与生物素去除法相当的效能。在添加患者样本之前,将链霉亲和素表面和生物素化捕获抗体孵育30-60min足以改善ELISA检测中84%-99%的生物素干扰。此外,预偶联复合物在自动化免疫测定的试剂盒中也能保持稳定的性能。我们得出结论,与生物素去除法工作流程相比,手工ELISA和自动化免疫测定的人力、测试成本以及周转时间都更有利。在生产商努力重新配置检测方法的同时,生物素去除可作为一种短期策略,提高检测已知生物素消耗患者样本的准确性,但不应被视为减轻敏感免疫检测中生物素干扰的长期解决方案。预偶联解决方案的实施可能相对简单,如在3种ELISA检测中,为了便于生物素化抗体固定到链霉亲和素表面,对方案中两个步骤的顺序进行了调整。使用机载试剂盒的检测形式可以在生产时预偶联或制备,以便实验室可以在放置在仪器上之前预混合试剂。预混试剂将避免在检测时进行预偶联而导致检测时间增加,因此更适合立即检测。
修改检测序列(例如,预偶联)或重新配制试剂以防止或缓解生物素干扰的检测,在整个临床实验室检测范围内,与去除法相比,具有显著优势。急症治疗环境尤其需要更多时间来明确患者的生物素摄入量或在检测前采用生物素去除方案。在这种情况下,也无法指导患者在重新检测时避免摄入生物素。临床医生可能并不总是了解检测对生物素的敏感性,也可能在不知情的情况下下达临床检测指令,指令被送到临床医生可能不熟悉实验室检测方法的二级地点。此外,抗链霉亲和素抗体和抗生物素抗体以前也有报道,生物素化蛋白质也可能在体内形成,但其流行程度尚不完全清楚。预偶联可以更好地防止这些额外形式的干扰,而去除法可能无法阻止抗生素抗体的干扰。
预偶联可在周转时间和检测成本方面带来立竿见影的效果,尤其是对于手工操作较多的检测,如我们实验室的S100、NSE和CYFRA21-1。对于无法获得残剩余链霉亲和素偶联磁珠的实验室来说,从供应商处采购这些试剂会大大增加每次检测的成本。值得注意的是,有些去除方案测试了更短的孵育时间(低至15min),并证明了其有效性,但是,样本孵育后还需要10min的离心步骤,这仍会导致TAT总体增加25-30 min。从概念上讲,预偶联的分析准确度也可能更高,因为对照、校准品和患者样本将以相同的方式处理,并且不需要实验室工作人员进行任何额外的样本操作。这对于测定游离激素(例如FT4和游离三碘甲状腺原氨酸)的内分泌测定尤其重要,因为缓冲珠中的任何残留液体都可能稀释分析物浓度或破坏游离-结合平衡。去除方案要求采购磁珠、去除磁珠装置和初始试验验证,然后要求对每个测试的样本同时进行QC测试,这些因素成为检测实验室在技术、合规性和能力方面的负担。此外,在B公司分析平台上,去除方案还增加了CV和分析不精确度,在A公司自动平台上对不精确度进行的正面比较显示,与对照组相比,预偶联试剂盒的不精确度没有增加。易受生物素干扰的平台非常普遍,尽管所有受影响的免疫测定方法不一定都有重大临床风险,如一些生产商正在修改和发布新的方法,将干扰阈值提高到不符合一般或治疗用途的浓度,生产商直接提供的标准化解决方案将减轻临床医生和实验室人员识别错误结果、重复检测和额外样本处理的责任。
未来对预偶联方法的研究应包括对预偶联复合物稳定性的全面评估,我们的研究表明,预偶联Tg试剂在A公司平台上至少能稳定使用25d。今后对其他免疫测定中数天至数月的稳定性进行调查,对于评估生产商如何实施这一策略至关重要。在将测定物放入仪器前进行预偶联,可以缩短实验室内的检测时间。本研究在血清中对预偶联法进行了评价,然而,该技术可能适用于含有游离生物素和具有链霉亲和素结合能力的代谢物的其他类型样本,如尿液。游离生物素干扰导致的不良结果仍是临床关注的问题,高剂量生物素摄入量的增加也提高了链霉亲和素检测中生物素干扰的风险。临床实验室和生产商一直需要解决生物素干扰问题,并设计出降低风险和报告准确结果的方法。我们证明,将生物素化的捕获抗体与链霉亲和素预偶联可提高生物素耐受性,从而获得更准确的结果,同时与生物素去除法相比缩短了周转时间并降低了成本。
编译节选自:The Journal of Applied Laboratory Medicine, Volume 7, Issue 3, May 2022, 762-775




