新型化学发光免疫法检测血浆醛固酮对原发性醛固酮增多症诊断的临床价值
【摘要】在日本,用于诊断原发性醛固酮增多症(PA,简称原醛症)的血浆醛固酮浓度(PAC)的标准测量方法已从放射免疫分析法(RIA)改为新型的化学发光酶免疫分析法(CLEIA)。本研究的目的是模拟这种变化对PA诊断的可能影响。这项回顾性研究评估了2,289例PA患者,将常规RIA测得的PACs转化为估算PACs(CLEIA)的方法如下:RIA(pg/mL)=1.174×CLEIA(pg/mL)+42.3。我们将估算PAC(CLEIA)应用于卡托普利试验(CCT)的醛固酮-肾素活性比值≥200以及生理盐水输注试验(SIT)的PAC≥60pg/mL的常规临界值(cut-off)。将估算PAC用于筛查和确诊试验,CCT和SIT(差异病例)的PA诊断数量分别减少了36%(743/2,065)和52%(578/1,104),在差异病例中,87%(548/628)的CCT和87%(452/522)的SIT是双侧肾上腺静脉采血(AVS)。CCT和SIT差异病例中分别有6%(36/579)和5%(23/472)的醛固酮腺瘤(APAs)可通过手术治疗,大多数APAs表现为低钾血症和/或CT成像中的肾上腺结节。将新型CLEIA测量的PAC应用于常规临界值可减少PA诊断的数量。尽管大多数差异病例AVS是双侧的,但也有一些APA病例以低钾血症和/或CT肾上腺肿瘤为特征,需要进一步研究同时评估RIA和CLEIA测量的PAC,以确定CLEIA测量PAC的新临界值。
【关键词】原发性醛固酮增多症;化学发光酶免疫测定法;血浆醛固酮浓度
原发性醛固酮增多症(PA)的特征是肾上腺自主分泌醛固酮,从而导致高血压和低钾血症。自从测量血浆醛固酮浓度(PAC)和通过醛固酮-肾素活性比值(ARR)筛查PA的方法建立以来,PA诊断的数量急剧增加,目前,PA是继发性高血压的主要病因,在高血压患者中的患病率为5%-10%。关于醛固酮测量,PAC方法和标准方法的一些变化影响了临床PA的诊断。液相色谱/串联质谱法(LC-MS/MS)测量PAC在日本不适用,因为国家健康保险制度规定了每次实验室检查的费用。因此,临床上应用放射免疫法测量PAC和血浆肾素活性(PRA)。然而,放射免疫检测存在放射性同位素使用和处置、人工检测复杂、标准物质溯源性差、低浓度检测灵敏度低等问题。因此,我们开发了一种双位夹心化学发光酶免疫分析法(CLEIA),利用固定在铁氧体颗粒上的单克隆抗体来测量PAC,并于2021年4月在日本推出。PAC的CLEIA可以使用醛固酮标准物质进行内部校准,该方法对醛固酮标准物质具有良好的溯源性,并与LC-MS/MS测量值具有良好的相关性。
另一方面,CLEIA得出的数值远低于RIA得出的数值,因此将CLEIA测得的PAC应用于PA筛查和确诊试验的常规临界值,极有可能减少诊断为原发性高血压的PA病例数。因此,在当前的研究中,我们评估了从传统RIA到新型CLEIA的PAC测量方法对PA诊断的影响,使用了一个基于传统RIA测量PAC的大型多中心日本PA注册中心,使用转换公式将传统RIA测量的PAC转换为估算的PAC(CLEIA),将估算的PAC(CLEIA)应用于筛查试验、CCT和SIT的常规临界值,并评估未通过估算的PAC(CLEIA)诊断为PA但被视为差异病例的患者数量和差异病例的临床特征。
一、研究对象与方法
1. 背景和参与者:我们对纳入日本罕见/难治性肾上腺疾病研究(JRAS)的患者进行了一项回顾性观察队列研究,JRAS是一项来自41个转诊中心的全国患者登记系统,纳入年龄20-90岁、接受肾上腺静脉采血(AVS)的PA患者。我们使用了2019年5月获得的JRAS数据集,其中包括2006年1月至2018年12月登记的患者。由于本研究为回顾性研究,患者肾上腺切除术的适应症由各中心的医生根据AVS结果和其他临床特征确定。我们纳入了筛查试验中ARR≥200且PAC≥120pg/ml,并通过CCT或SIT确诊的PA患者。仅通过速尿继发试验(FUT)确诊的PA患者和重要临床变量数据缺失的患者未纳入分析。
2. 原发性醛固酮增多症的诊断:PA的诊断依据日本内分泌学会和日本高血压学会的指南,血浆ARR升高(≥200,PAC单位为pg/ml,PRA单位为ng/ml/h)的高血压患者至少接受了一项确诊试验,即CCT或SIT。如果可能,在检测前用钙通道阻滞剂或α-受体阻滞剂替代降压药物。如果服用50mg卡托普利后60或90 min的ARR≥200,则认为CCT阳性,如果2L盐水输注4h后的醛固酮水平≥60.0pg/ml,则认为SIT阳性,PA的诊断基于至少一次阳性的确诊试验结果。
3. 临床特征的确定:使用RIA(SPAC-S醛固酮试剂盒)测量PAC,PRA采用RIA(PRA-FR RIA试剂盒;PRA RIA试剂盒)和酶免疫测定(PRA EIA试剂盒)进行测量。低钾血症定义为接受钾补充剂或血清钾水平<3.5mEq/L。在CT中检测到的肾上腺结节被定义为直径至少为10.0mm的结节。
4. CLEIA测量的PAC估算:本研究的目的是评估在PA诊断中将传统的RIA改为CLEIA测量PAC的影响。因此,我们使用RIA测量的PAC值估算了CLEIA测量的PAC值。估算的PAC(CLEIA)用以下公式计算:CLEIA(pg/ml)=[RIA(pg/ml)-42.3]/1.174。该公式是根据RIA测量的PAC与LC-MS/MS测量的PAC之间的关系得出的,应该与CLEIA测量的PAC等值,由于PAC在CLEIA的检测限,估算PAC(CLEIA)<4pg/ml定为4pg/ml。
5. 肾上腺切除术的结局评估:原发性醛固酮增多症手术结局(PASO)研究人员就PA单侧肾上腺切除术后的结局评估达成了国际共识。在本共识中,临床和生化结局根据手术结果分为完全缓解、部分缓解或未缓解。在本研究中,生化获益的定义为PASO共识中的生化结局完全或部分缓解,术后6-12个月进行疗效评估。
6. 肾上腺静脉采血(AVS):上腺血液样本是通过经皮股静脉途径连续插管获得的。在整个手术过程中,通过推注、推注后持续输注或仅持续输注方式给予促肾上腺皮质激素cosyntropin,促肾上腺皮质激素(ACTH)刺激后选择性指数(SI)≥5定义为肾上腺静脉插管成功。单侧醛固酮增多症定义为ACTH刺激后偏侧化指数(LI)≥4,为最常用的临界值。SI定义为肾上腺静脉与下腔静脉皮质醇水平的之比,LI的计算方法为优势侧醛固酮-皮质醇比值除以非优势侧醛固酮-皮质醇比值。
7. 醛固酮腺瘤和特发性醛固酮增多症的定义:如果PA患者接受了肾上腺切除术,并且根据PASO标准有病理证据表明腺瘤有生化获益,则诊断为醛固酮腺瘤(APA),如果PA患者未行肾上腺切除术且AVS成功后LI<4或者PA患者行肾上腺切除术且无病理证据显示腺瘤或PASO标准生化未缓解,则诊断为特发性醛固酮增多症(IHA)。
8. 统计分析:连续变量以平均值±标准差或中位数(四分位距)表示,采用Mann-Whitney U检验进行比较,Fisher精确检验用于比较分类变量,p<0.05为差异有统计学意义。为了在临界性PA病例中确定APA的最佳总体预测因素,我们对那些在单变量分析中APA和IHA之间有显著差异的临床变量进行了logistic回归模型,并在p=0.1处进行了后向变量消除,采用C统计量的受试者工作特征曲线分析预测APA,使用SPSS 22版(IBM公司)进行统计分析。
二、研究结果
1. 研究人群:在JRAS数据集中有信息的3,689名患者中,我们排除了PAC和PRA筛查数据缺失或不完整信息的患者以及CCT和SIT结果均为阴性的患者。因此,本研究总共纳入了2,289名患者。为了评估PAC测量方法的变化对CCT和SIT临界值可能产生的影响,将患者分为两个数据集,CCT数据集:通过CCT诊断的PA患者(n=2,065),SIT数据集:通过SIT诊断的PA患者(n=1,104)(见图1)。
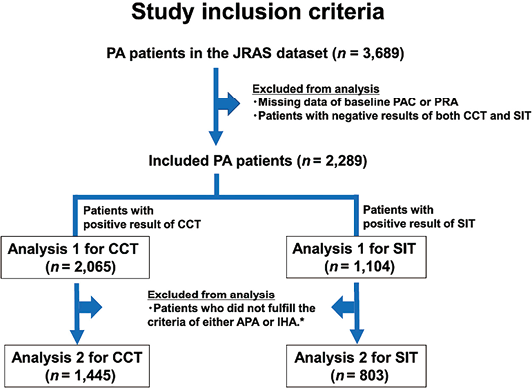
注:PA:原发性醛固酮增多症;JRAS:日本罕见/难治性肾上腺疾病研究;PAC:血浆醛固酮浓度;CCT:卡托普利试验;SIT:生理盐水输注试验;APA:醛固酮腺瘤;IHA:特发性醛固酮增多症;PASO:原发性醛固酮增多症手术结局
图1. 当前研究的纳入标准
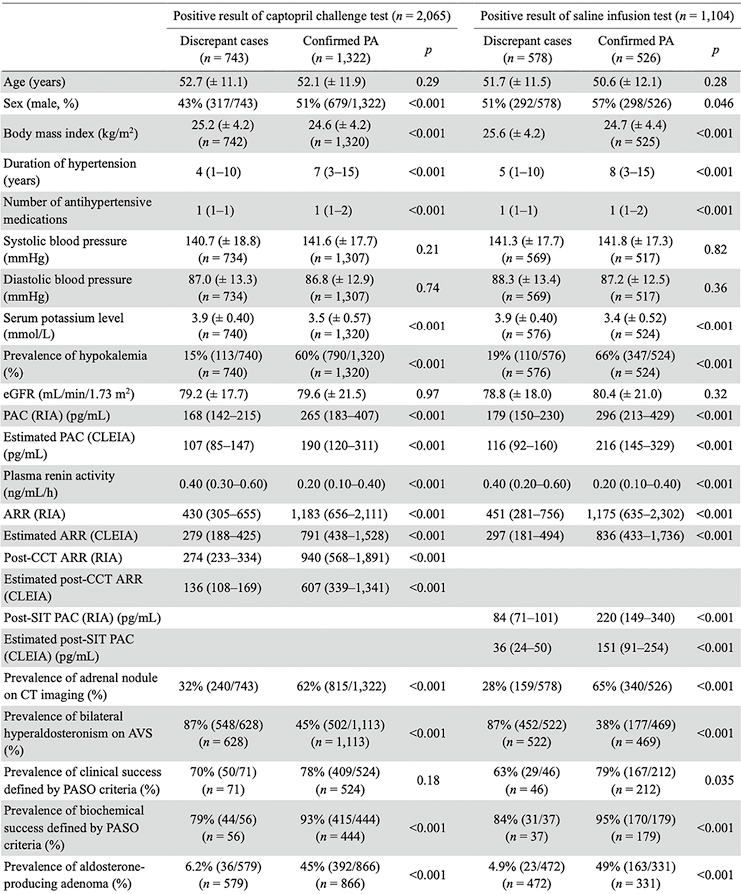
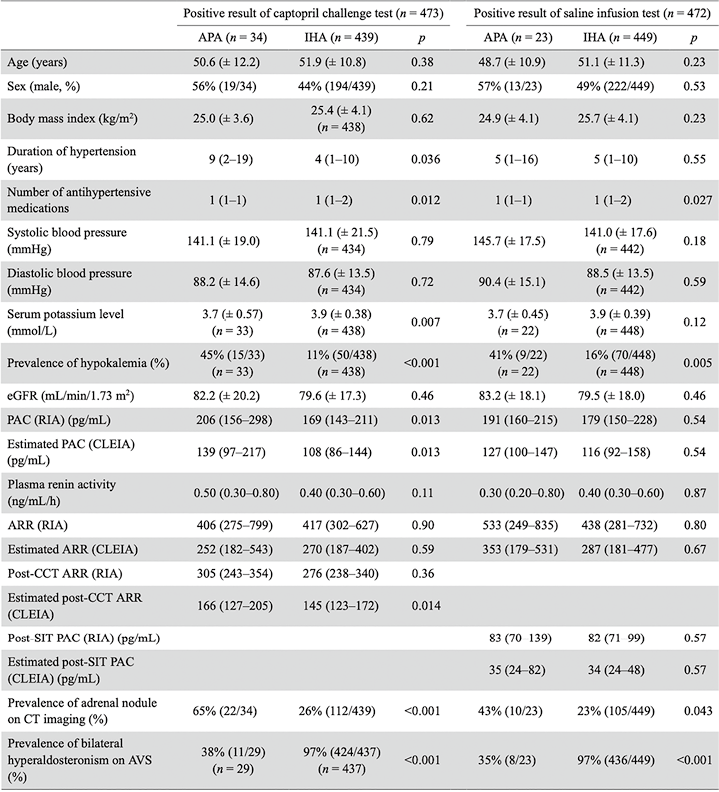
2. 使用常规筛查和确诊试验的临界值估算ARR和PAC(CLEIA)对PA诊断的影响:在分析1中,我们使用筛查和确诊试验的常规临界值评估了估算ARR和PAC(CLEIA)对PA诊断的影响(见图1)。在CCT分析1中,将估算PAC(CLEIA)应用于筛查和CCT后ARR的常规临界值200,使PA诊断数量减少了36%(2,065例中的743例)(差异病例)。这与差异病例相比(见表1),在使用估算ARR(CLEIA)(确诊PA)进行筛查和CCT结果阳性的PA患者中,PAC、ARR和CCT后ARR显著较高,PRA和BMI显著较低。此外,确诊为PA的参与者更有可能是男性、低钾血症和CT影像学上有肾上腺结节。重要的是,87%(548/628)的差异病例在AVS上被诊断为双侧醛固酮增多症,6.2%(36/579)的APA可手术治疗,在确诊PA组中,上述比例分别为45%(502/1,113)和45%(392/866)。
在SIT分析1中,将估算PAC(CLEIA)与筛查ARR的常规临界值200和SIT后 PAC的常规临界值60相比,PA诊断数量减少了52%(578/1,104)(差异病例)。与差异病例相比(见表1),PAC、ARR和SIT后PAC在使用估算计PAC(CLEIA)筛查和SIT结果呈阳性(确诊PA)的PA患者中显著较高,PRA和BMI显著较低。此外,确诊为PA的患者更多为男性,更有可能有低钾血症和CT影像上的肾上腺结节。87%(452/522)的差异病例在AVS上被诊断为双侧醛固酮增多症,4.9%(23/472)的APA可手术治疗,在确诊为PA的患者中,上述比例分别为38%(177/469)和49%(163/331)。
表1. 分析1中差异病例和确诊原发性醛固酮增多症患者的基线临床特征
3. 根据CCT和SIT估算的ARR和PAC(CLEIA)划分的APA和IHA病例分布情况:为了评估差异PA病例中APA和IHA的患病率,我们从分析1的数据集中排除了不符合APA或IHA标准的患者(见图1)。首先,评估了每组中APA的患病率,按估算筛查ARR(CLEIA)、CCT后ARR(CLEIA)和SIT后PAC(CLEIA)的四分位数进行分类。如图2所示,估算筛查ARR(CLEIA)、CCT后ARR(CLEIA)和SIT后PAC(CLEIA)越高,APA患病率越高。接下来,根据筛查和CCT(CLEIA)的估算ARR和SIT的PAC(CLEIA)评估了APA和IHA病例的分布情况(图3A和B)。重要的是,8.4%(36/428)的APAs在CCT诊断的患者中是不一致的。然后,为了减少筛查和CCT的ARR常规临界值所忽视的病例数,我们将估算筛查或CCT ARR(CLEIA)在100-200之间的PA患者定义为临界病例。在临界病例中,7.2%(34/473)为APA病例,他们的低钾血症和CT成像中肾上腺结节的发生率也较高,PAC和CCT后ARR(CLEIA)也较高(2例APA病例的CCT后ARR<100)(见表2)。对低钾血症患病率、CT成像上的肾上腺结节、估算PAC(CLEIA)和CT后ARR(CLEIA)进行后向消除的多变量logistic回归表明,低钾血症患病率和CT成像上的肾上腺结节是临界病例中APA的独立预测因素,C统计量为0.833(95%置信区间为0.780-0.886)(见图4)。
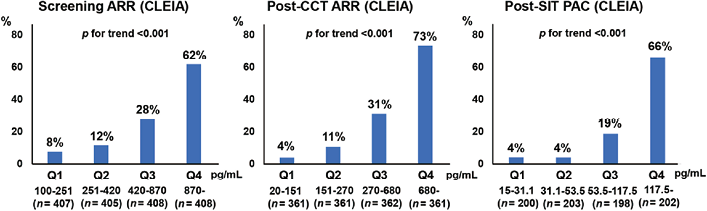
图2. 按估算筛查ARR(CLEIA)、CCT后ARR(CLEIA)和SIT后PAC(CLEIA)四分位数分类的群体中APA的患
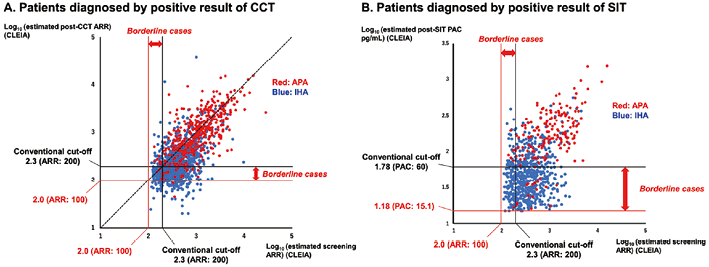
图3. 在分析2中根据估算筛查ARR和确诊试验结果,APA和IHA病例的分布
在SIT方面,12%的APAs(23/186)出现差异,为了减少筛查时ARR和SIT的PAC为常规临界值而忽略的病例数,将估算筛查ARR(CLEIA)在100-200之间或SIT后PAC(CLEIA)在15-60pg/mL之间的PA患者定义为临界病例。在临界病例中,4.9%(23/472)患有APA,他们的低钾血症和CT成像中肾上腺结节的患病率也较高(表2)。对低钾血症的患病率和CT影像上的肾上腺结节进行后向消除的多变量logistic回归显示,这两个变量是临界PA中APA的独立预测因素,C统计量为0.676(95%置信区间0.551-0.801)(见图4)。
表2. 临界PA病例中APA和IHA的基线临床特征
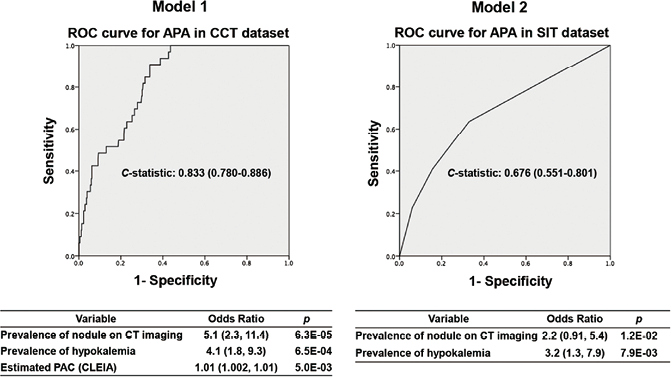
注:模型1,包括肾上腺结节的患病率、低钾血症的患病率,估算PAC(CLEIA)和估算CCT后ARR(CLEEA);模型2,包括肾上腺结节的患病率和低钾血症的患病率
图4. 使用后向消除的logistic回归分析和ROC曲线分析来预测APA与IHA
4. PA管理的可能算法:图5显示了本研究中每组的患者数量。经CLEIA测量PAC的常规筛查临界值诊断为PA的患者,建议行AVS,并根据AVS的结果和其他临床特征考虑行肾上腺切除术,因为这些患者中可通过手术治疗的APA患病率较高。另一方面,由于IHA发病率较高,并不是所有的临界病例都建议进行AVS。在临界病例中,评估临床特征(尤其是血清钾水平)和肾上腺结节的CT成像对于确定AVS和肾上腺切除术的适应症非常重要。例如,在471例CCT临界PA中,有170例发现低钾血症或CT成像中肾上腺结节,这些患者占临界PA组APA病例的88%(29/33)。在SIT检测的470例临界PA中,共有162例发现低钾血症或CT成像中肾上腺结节,这些患者占临界PA组APA病例的64%(14/22)。
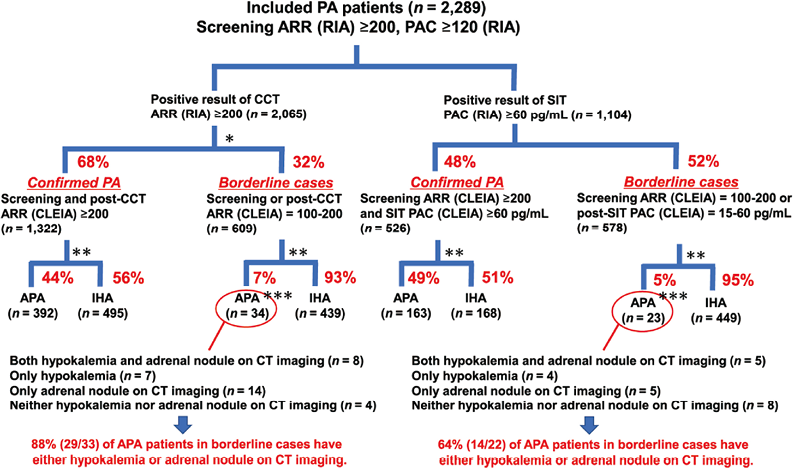
注:*CCT后ARR低于100的患者被排除在外(n=134);**不符合APA或IHA标准的患者被排除;***只有一名患者没有血清钾数据,无法区分是否患有低钾血症
图5. 当前研究中每组患者的数量
三、分析与讨论
尽管PA是继发性高血压最常见的形式,在高血压患者中患病率达到5%-10%,但用于测量PAC的RIAs存在方法学问题,这对于PA的筛查和诊断至关重要。例如,该测定法已证明其灵敏度和重复性存在局限性,特别是在肾上腺静脉样本中的较低浓度范围和较高浓度范围。在这方面,新型双位点夹心CLEIA已证明对醛固酮标准物质具有良好的溯源性,在较宽的浓度范围内(包括较低浓度)具有良好的线性,并且与LC-MS/MS结果具有良好的相关性。此外,CLEIA法与LC-MS/MS法测量的PAC具有良好的可比性,可用于PA诊断的国际比较。因此,CLEIA法可作为日常临床工作中测量PAC的标准方法。
另一方面,CLEIA测量的PAC明显低于RIA获得的值,并且使用CLEIA诊断PA的筛查和确诊试验的新界值仍有待解决。在当前的研究中,我们评估了从传统RIA到测量PAC的新型CLEIA的变化对PA诊断的影响。重要的是,将新型CLEIA测量的PAC应用到筛查和确诊试验的常规临界值中,显著减少了诊断数量,尤其是双侧醛固酮增多症的诊断数量。另一方面,有一些可手术治疗的APA被误诊为原发性高血压。这些结果带来了一个问题:什么是PA、应该如何诊断PA、应该如何治疗PA?Conn首先描述了以高血压、低钾血症和单侧肾上腺结节为表型的典型PA,其病理表现为腺瘤,最近的报道表明,对这些单侧PA,手术治疗比药物治疗效果更好。另一方面,ARR的引入和对高血压患者的广泛筛查使轻度PA的诊断增加了5-15倍。多数轻度PA患者血钾正常,AVS提示双侧醛固酮增多症,可采用盐皮质激素受体拮抗剂治疗。因此,临床指南强烈推荐AVS作为PA亚型诊断的标准,以决定手术指征。然而,尽管过去十年来PA诊断数量显著增加,AVS的实施及其技术发展,肾上腺切除术的总体比率仅相当于接受AVS的PA患者的三分之一。由于AVS的侵入性和技术要求高、成本高、辐射暴露等问题,其诊断效率有待提高。鉴别哪些单侧PA患者可从肾上腺切除术中获益最大仍是至关重要的,并且需要改进双侧亚型的无创AVS前预测,尤其是在日本。本研究中使用CLEIA测量的PAC按常规临界值诊断出的PA是AVS的良好指征,因为其在可手术治疗的APA中发病率较高,另一方面,大多数临界病例最终被诊断为IHA(双侧醛固酮过多症)。因此,将这些临界病例诊断为PA是否有意义?
Sartoli等将筛查试验阳性而确证试验阴性的高血压患者定义为患醛固酮相关性高血压。他们还发现,在22个月的随访中,醛固酮相关高血压患者和确诊PA患者发生难治性高血压的数量相似。Shibata等将不符合PA诊断标准的高血压合并高醛固酮血症患者定义为盐皮质激素受体相关高血压患者的一个亚型,这可能是由醛固酮-盐皮质激素受体轴的病理生理学激活引起。此外,最近的一份报告表明,在PA的分类定义之外,普遍存在不依赖肾素的醛固酮生成连续统一体,这与高血压的严重程度相似,这意味着PA是一种临界性疾病。因此,尽管由于APA患病率较低,对这些临界病例进行AVS的必要性可能较低,但阻断这些患者的盐皮质激素受体轴可能会改善预后。需要进一步的研究来阐明PA临界病例在药物治疗和自然病程方面的诊断可能的重要性。
在当前的研究中,我们还发现大约5%的临界病例具有可手术治疗的APA。这些APA得到了肾上腺切除术的病理结果和PASO标准的生化获益的证实。理论上,肾上腺切除术通过去除产生肿瘤的醛固酮来治愈这种疾病。重要的是,越来越多的证据表明,对于APA,药物治疗的结果不如手术治疗。因此,内分泌科医生在临床环境中误诊这些APA是不利的。值得注意的是,在目前的研究中,这些APA可以通过临床特征(包括低钾血症和CT成像上的肾上腺结节)来区分临界病例。这两个临床因素对于鉴别APA也很重要,不仅在临界病例中,而且在确诊PA的病例中(数据未显示)。这些结果表明,即使是在有低钾血症或CT影像上有肾上腺结节的临界病例中,AVS也有必要进行详细的评估。
本研究的优势在于我们使用了接受AVS的PA患者的大型多中心数据集。本研究中APAs是由病理结果和手术结局共同定义的,这加强了对APAs的解读。另一方面,本研究的一个重要局限性是没有通过CLEIA直接测量PAC。RIA测量PAC存在患者内变异,可能会限制结果的解释。此外,我们使用CLEIA(pg/ml)=[RIA(pg/ml)-42.3]/1.174的公式来估算CLEIA测量的PAC,该公式是基于RIA测量的PAC与LC-MS/MS测量的PAC之间的关系,应该与CLEIA测量的PAC等值。因此,本研究是基于推测,需要将CLEIA测量的PAC与RIA测量的PAC进行直接比较。
此外,我们只纳入了接受AVS的PA患者,这可能会增加PA中APA的比例,而不是真实比例,这是一种选择偏差。最后,本研究中的PA患者是根据日本临床实践指南进行诊断的,这一定程度上限制了其在其他国家临床实践中的应用。
编译节选自:Endocrine Journal. 2023 Volume, 70 Issue 5, Pages 489-500.




