全球乳腺癌流行病学特点与诊断方法及预防措施
乳腺癌由于高死亡率和发病率而成为女性的主要健康问题,即使进行辅助化疗,转移性乳腺癌的五年生存率也不到30%。IARC(国际癌症研究机构)从185个国家发布的最新GLOBOCAN 2018数据报告了230万例乳腺癌新病例(11.7%),死亡率为6.9%,高收入国家(571/10万)的乳腺癌发病率高于低收入国家(95/10万),反映了全球化。由于存在反映不同分子特征和临床病理特征的各种生物学亚型,乳腺癌通常被称为一组疾病(>100)。除了组织学亚型之外,基因表达谱还将乳腺癌分为不同的分子亚型,即受体阳性[Luminal A型、Luminal B型、正常样和HER-2(人表皮生长因子受体2)阳性]和受体阴性[TNBC(三阴性乳腺癌)](图1)。Lehmann等人根据不同基因的表达,进一步鉴定了TNBC亚型基底样-1,基底样-2,免疫调节,间充质,间充质干细胞和雄激素受体中命名的不同组。总体数据表明,这些乳腺癌亚型具有不同的组织病理学和临床表现,并与不同的年龄组和种族相关,如三阴性乳腺癌和HER-2阳性亚型在年轻和绝经前女性中尤其常见,在非洲裔和亚洲女性中更常见,表现出更高的潜在转移和高复发率。
在发达国家,生活方式改变、结婚年龄推迟、晚育第一胎、深夜工作和激素替代治疗是乳腺癌发生的主要危险因素。在发展中国家,乳腺癌高发病率和死亡率的主要原因是缺乏对该病的适当认识或知识、不适当的筛查项目、延迟诊断和医疗设施不足。乳腺癌有多种治疗方法,包括手术、放疗、化疗、内镜治疗和免疫治疗。尽管有了这些疗法,乳腺癌的发病率和死亡率仍然很高。为了解决这一问题,多项组学研究发现乳腺癌的肿瘤内和肿瘤间异质性是导致治疗后复发或耐药的主要原因。此外,科研人员和临床医生正在不断发展或改进现有的知识和技术,以探索乳腺癌的肿瘤异质性。测序工具(如二代测序、单细胞测序、空间基因表达谱和生物信息学支持)的改进或进步正在为肿瘤异质性提供重要支持,此外,一些权威机构正在对乳腺癌高危女性进行筛查,以降低乳腺癌发病率。但一些新的乳腺癌病例仍在增加,主要原因是这些设施的可用性方面缺乏准确的信息和闭环。下文编译将主要总结预防乳腺癌风险可能的措施。
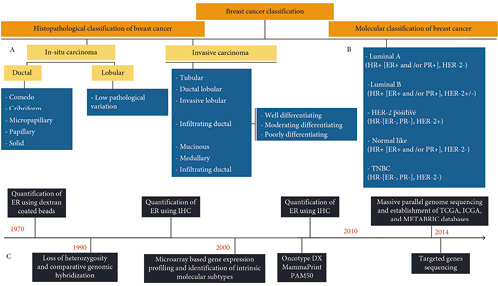
图1.(a)组织病理学分类,(b)分子分类,(c)理解乳腺癌生物学过程中的重要事件时间线
一、乳腺癌流行病学特点
2018年,全世界约有680万女性患有乳腺癌,但是癌症登记系统的信息不完整,只记录了发病率或死亡率,没有记录有多少患者发生转移扩散和癌症治愈。教育水平、经济状况、环境条件、饮食习惯、生活方式因素和其他文化习俗的巨大差异导致世界各地乳腺癌发病率的差异。到2040年,全球化和经济增长可能会进一步加剧发展中国家(64%-95%)和发达国家(32%-56%)的乳腺癌发病率。在印度的城市,据报道高乳腺癌发病率在40-49岁年龄组,而农村地区在65-69岁年龄组,在一项来自印度北部人群的研究表明,大约26%被检出的乳腺癌患者年龄小于35岁,饮食模式的差异,如烟草(吸烟与不吸烟)、饮酒(烈酒与葡萄酒)和非素食饮食(大量红肉与少量红肉)也是乳腺癌发病率差异的原因。
二、乳腺癌诊断方法
开展广泛的乳腺癌信息计划以提高人们对乳腺癌危险因素和发病率的认识至关重要。此外,筛查项目和诊断检测对于早期发现乳腺癌以降低乳腺癌发病率和死亡率负担至关重要。
1. 乳腺癌分子检测:乳腺癌是一种由于基因组结构改变而导致的遗传性疾病,肿瘤抑癌基因和致癌基因的遗传改变将乳腺上皮细胞转化为恶性表型,这些遗传改变也影响乳腺癌的治疗反应和临床结局。分子检测技术的显著进步使乳腺癌的诊断和治疗决策更加便捷,目前,将传统的组织病理学方法与分子检测相结合,可以更准确地对乳腺癌分子亚型进行分型,分子诊断对乳腺癌的治疗产生了前所未有的影响,分子检测有助于识别一组特定的基因作为生物标志物,可能有助于预测疾病的预后和治疗的疗效。如,PAM50(预测分析微阵列50)是FDA批准的多基因试剂盒,用于评估乳腺癌和ER(雌激素受体)阳性、HER-2阴性、淋巴结阴性和>5cm肿瘤大小乳腺癌的预后。基于微阵列的PAM50由50个基因组成,用于检测绝经后妇女诊断乳腺癌后10年内的远处复发风险,如果PAM50评分很高,则显示出相当高的转移风险,建议进行相应的计划治疗。ONCOTYPE DX是另一种检测试剂盒,这是一种21基因表达测定的乳腺癌预测模型,可计算乳腺癌复发的风险,onCOTYPE DX使用肿瘤切片提供信息,预测局部区域疾病复发,这有助于对ER/PR(孕激素受体)阳性和淋巴结阳性的绝经后乳腺癌患者进行放疗决策。ENDOPREDICT(EndoPredict®)是基于RNA的12个基因(8个癌症相关基因,3个内参基因和1个用于检测DNA污染的对照基因)检测试剂盒,有助于提供DCIS(导管原位癌)风险和疾病复发的信息,ER阳性、HER-2阴性、I/II期和淋巴结阴性的患者适合进行ENDOPREDICT检测。此外,MammaPrint由位于阿姆斯特丹的荷兰癌症研究所(NKI)设计并于2007年获得FDA批准,MammaPrint是一种基于微阵列的商业化检测方法,可检测70种基因的表达,可预测ER/PR+/-、I期或II期、>5cm和3个或更少淋巴结的早期乳腺癌的转移,它预测了I期或II期激素受体阳性和激素受体阴性肿瘤在诊断后10年内的复发,在临床高危和70基因特征的低危患者的IMPACT试验中,治疗建议减少了60%。此外,尿激酶型纤溶酶原激活剂(一种分解细胞外基质并有助于转移的蛋白水解酶)是另一种预后计算检测试剂盒,纤溶酶原通过组织型纤溶酶原激活剂(tPA)和尿激酶纤溶酶原激活剂(uPA)转化为其活性形式的纤溶酶,从试验报告中可以明显看出,uPA和PAI-1(纤溶酶原激活物抑制剂-1)水平升高预示着不良的临床结果。同样,乳腺癌指数测试预测激素受体阳性和淋巴结阴性的患者诊断5至10年后的癌症复发。因此,分子诊断分析被整合为乳腺癌管理的一部分,因为它们可以估计转移,肿瘤复发和治疗反应的风险,结果有助于临床医生确定患者激素治疗的时间范围。
2. 乳腺癌的NGS测序:改进传统测序技术,在单次实验中对整个基因组进行深度读取计数和分析,这是分子生物学领域前所未有的成就,被称为下一代测序(NGS)的大规模并行和深度测序技术彻底改变了基因组研究。下一代测序是一种经济高效的方法,可在一组实验中使用多基因面板(panels)提供完整的基因组信息,这种高通量技术提供了基因变异,基因改变,点突变,基因融合和拷贝数变异的信息,这种先进的测序技术因有助于患者特异性治疗在乳腺癌诊断中已被全世界广泛接受。NGS在诊断领域流行的多种原因可归因于几个额外的优势,包括超高通量、可扩展性和速度。可逆染料终止子法(Illumina)和半导体离子质子法(ThermoFisher Scientific)、SMRT PacBio和Nanopore(Oxford)对不同体细胞和生殖细胞突变(SNP、CNV、Indel、易位和基因表达)、蛋白表达和表观遗传改变的鉴定具有较高的准确性和敏感性。RNA测序(RNA-Seq)可以量化不同组织中不同细胞RNA种类的拷贝数并可以发现新的或剪接位点的mRNA变异。NGS还可研究全基因组表观基因组修饰,例如组蛋白修饰,DNA甲基化和DNA-蛋白质相互作用。类似地,牛津纳米孔技术公司开发的纳米孔DNA测序设备是一个简单的实验过程,当分子通过悬浮在膜上的小孔时,直接分析DNA链,G,A,T和C核苷酸的不同组合通过由蛋白质组组成的孔时,设备根据电流的变化开始工作,这种经济高效的方法具有读取无需标记、超长(104-106碱基)测序、快速处理、实时结果显示和即使用少量材料也能生成高通量数据。肿瘤的表型和分子异质性是导致治疗失败和治疗耐药的主要原因,了解和解读肿瘤异质性将有助于提高乳腺癌患者的生存率,在这种情况下,使用模板转换的单细胞测序方法在解码肿瘤异质性方面比批量测序数据更具优势。
此外,利用空间分辨的高分辨率转录组学来绘制完整组织切片的空间组织,可以破译肿瘤的异质性。空间分子成像技术,包括顺序荧光原位杂交(seqFISH)、荧光原位测序(FISSEQ)、GeoMx、Slide-seq、STARmap、高清空间转录组学(HDST)、和多重容错性荧光原位杂交技术(MERFISH),能够在形态完整的组织样本中以亚细胞分辨率分析来自单细胞的数千种RNA和蛋白。空间分子成像结合了高倍分析和高分辨率成像的功能,使研究人员能够可视化和量化组织切片上的靶向蛋白质和基因表达。此外,还有许多在线数据库包含乳腺癌的所有组织学分级信息,癌症基因组图谱(The Cancer Genome Atlas,TCGA)、基因表达综合数据库(Gene expression Omnibus,GEO)和国际乳腺癌分子分类学联盟(Molecular Taxonomy of Breast Cancer International Consortium,metaBRIC)等数据库有来自大量乳腺癌患者的遗传、转录组、蛋白表达和表观遗传信息,这些数据库还具有乳腺癌患者的临床病理特征,可用于荟萃分析。
3. 乳腺癌液体活检:肿瘤活检是在细胞水平确定疾病病理学以进行诊断的金标准方法,癌症中存在的空间和时间异质性限制了实体瘤活检的优势。临床不建议重复有创操作,液体活检因标本提取方便、成本低廉等优点,可克服上述缺点,并且可以重复进行以监测疾病进展。由于液体活检的有效性,它似乎是诊断的未来。DNA测序和分子诊断的最新发展促进了循环肿瘤DNA(ctDNA)成为液体活检的标志物。目前,FDA批准的检测试剂盒,例如用于非小细胞肺癌治疗监测的Cobas EGFR突变测试V2,用于检测结直肠癌的Epi-procolon测试以及Guardant360 CDx和FoundationOne液体CDx可提供临床相关信息。同样,CellSearch是另一种FDA批准的试剂盒,用于评估转移性乳腺癌,结肠癌和前列腺癌中的CTC(循环肿瘤细胞)。一项研究使用超高灵敏度多重数字液滴PCR在171名乳腺癌患者的外周血中循环肿瘤DNA中筛选了ESR1(p.Leu536Arg,p.Tyr537Ser,p.Tyr537Asn,p.Tyr537Cys和p.Asp538Gly)。在一项临床试验中,早期TNBC患者接受了新辅助化疗,检测到的ctDNA与总生存率,无病生存率和无远处转移生存率呈负相关。因此,液体活检测序分析是一种很有前景的选择,可以以更小的创伤性操作提取体细胞突变图谱信息。
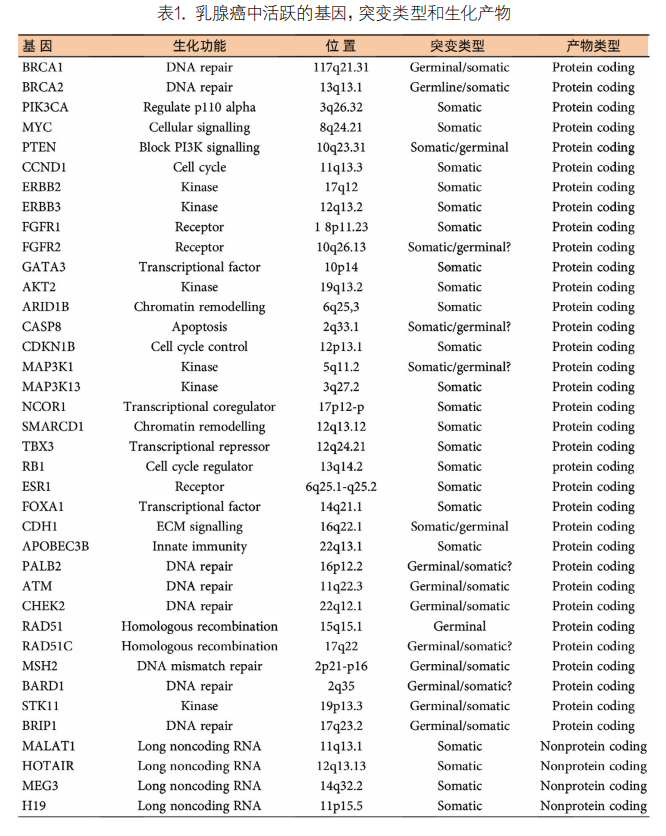
4. 乳腺基因诊断:在基因测序技术和生物信息学工具发展的支持下,基因检测可有效检测乳腺癌患者的种系(胚系或生殖系)突变。乳腺癌的基因检测对患者及其亲属的癌症预防、早期发现和治疗有重大意义(表1)。过去30年来,用于预测遗传性乳腺癌风险的种系基因检测有了显著发展。用于早期乳腺癌检测的肿瘤细胞中,报道的最常见的突变和/或扩增基因是TP53(41%的肿瘤)、PIK3CA(磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基α)(30%)、MYC(20%)、PTEN(第10号染色体缺失的磷酸酶及张力蛋白同源物)(16%)、CCND1(细胞周期素D1)(16%)、ERBB(Erb-B2受体酪氨酸激酶2)(13%)、FGFR1(成纤维细胞生长因子受体1)(11%)和GATA3(10%),目前已发现几种与遗传性乳腺癌相关的种系突变基因,包括BRCA1/2、CDH1(钙黏蛋白1)、PALB2(BRCA2的结合分子和定位分子)、PTEN、STK11(丝氨酸/苏氨酸激酶1)和TP53等基因与遗传性乳腺癌显著相关,家族中这些基因突变的携带者信息可以帮助管理家族中的遗传性疾病。BRCA1、BRCA2和PALB2突变与十分之一的乳腺癌发生相关,BRCA1和BRCA2突变分布于世界所有人群,BRCA1和BRCA2与45%的遗传性乳腺癌病例有关,寻找BRCA1和BRCA2突变,了解BRCA相关肿瘤的特定病理特征及其涉及的特定分子级联反应是必要的。携带致病突变的其他基因,如ATM(共济失调毛细血管扩张症突变)、CHEK2(检查点激酶2)、BARD1(BRCA1关联的RING域1)、BRIP1(BRCA1相互作用解旋酶1)、NBN(Nibrin)、RAD51C(RAD51同源物C)、RAD51D和NF1(神经纤维蛋白1)的乳腺癌风险增加2-4倍。家族史、人种和民族影响种系突变的发生率,因此在进行基因检测或风险评估时应考虑相关风险。乳腺癌通常是由多个低渗透性突变累积引起的,某些基因突变具有亚型特异性,即Luminal A型肿瘤具有较高的PIK3CA突变率(49%),基底样型肿瘤具有较高的TP53突变率(84%),BRCA基因突变多见于TNBC亚型,而CHEK2和ATM基因突变多见于ER阳性乳腺癌亚型。很少有研究为基因检测提供指南,2019年,美国乳腺外科医师学会(American Society of Breast Surgeons,ASBrS)建议对所有乳腺癌患者进行种系基因检测,以增加对病理性变异携带者的识别,根据美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)和ASBrS的指南,2020年梅奥诊所的一项研究提出了一种混合方法,使用NCCN老年患者标准对所有65岁的乳腺癌患者进行细菌基因检测。这与使用NCCN标准相比,使用≤60岁或≤65岁进行通用检测可检出更多的病理变异(分别为11.9%和15.7%)。尽管基因检测有很多好处,但仍有相当多的乳腺癌患者从未接受过基因检测,缺乏设施、患者意识、费用和遗传咨询人员不足是主要障碍。基因检测中也存在种族和民族差异,这可能影响这些人群的循证癌症监测、预防和治疗。综合和更新的指南用于识别BRCA携带者的BRCA检测将有助于预防和治疗目的。
5. 人工智能诊断:人工智能(AI)是一个旨在设计模拟人类智能计算机结构的新兴领域,机器学习(ML)属于人工智能,它设计了先进的算法来帮助理解疾病行为。越来越多的研究表明,ML可以提高乳腺癌的诊断率,并有助于预测预后。例如,Osareh等人借助针穿刺活检样本的数字化图像区分了良性和恶性肿块,同样,很少的研究者将数字组织病理学图像与DL技术相结合并进行解释,以鉴定乳腺癌样本中的组织学亚型和分级。此外,已经设计了算法来探索乳腺癌TME中的肿瘤间和肿瘤内异质性以及细胞亚群,例如嗜中性粒细胞,巨噬细胞和成纤维细胞。机器学习算法也被开发用于免疫组织化学亚型和ER/PR,HER-2阳性和Ki-67抗体阳性细胞的测量。此外,在AI的帮助下,Whitney等人预测了ER+乳腺癌患者的复发风险。在更先进的方法中,AI方法可用于确定增殖和细胞周期标志物的相关性,以进行个性化治疗。因此,上述数据有望为未来的AI提供更大的信息,可用于乳腺癌的诊断和治疗。
三、乳腺癌防治实施方法
1. 癌症登记:癌症登记是收集癌症发病率、死亡率、诊断和治疗数据的监测过程。政策制定需要做出必要的努力去控制癌症发病率并确定癌症预防的重点领域。目前,大多数癌症登记侧重于收集两个时间点的数据,即发病(诊断时)和死亡(死亡率)。为了更好地应对严重的乳腺癌状况,需要对病例进行深入的随访,进行生存评估和治疗反应,所有这些信息将有助于了解特定领域诊断、治疗和整体癌症服务的有效性。
2. 筛查计划:建立乳腺癌初级预防计划仍然是一个挑战,全人群乳腺癌筛查计划旨在通过早期发现和有效治疗降低乳腺癌死亡率,有效实施基于人群的筛查计划是当前的需要并且可能是改善妇女健康结果的一种方式。基于乳房X光检查的筛查非常有益,建议用于早期发现乳腺肿瘤。在英国(UK),年龄在50-71岁之间的女性每三年就会被邀请进行一次乳腺癌筛查,乳房X光检查可以检测是否存在任何异常,因此,广泛的筛查计划可以带来更多的生存机会。世卫组织提倡50-69岁年龄组每两年进行一次基于乳房X光检查的筛查,美国癌症协会建议每年对40-44岁年龄段的女性进行筛查。有时乳房X光检查会导致假阳性结果,为了改善这种情况,应使用风险预测模型进行风险分层,对于患有BRCA1和/或BRCA2突变的女性,建议将磁共振成像(MRI)和乳房X光检查结合使用,乳房X光随机对照试验表明,筛查可将乳腺癌死亡率显著降低20%。
3. 从实验室走向临床:分子技术已经发现了用于诊断、预后、耐药和治疗的不同类型的生物标志物。这些生物标志物可能有助于解决乳腺癌治疗中的耐药问题。DNA甲基化模式的改变与肿瘤的发生有关。例如,超过90%的乳腺癌患者存在腺瘤性结肠息肉病(APC)和维甲酸受体2(RARb2)基因启动子甲基化。Yang等利用BeadChip DNA研究中的人类甲基化,观察到S100钙结合蛋白P(S100P)和透明质酸氨基葡萄糖苷酶2(HYAL2)的低甲基化与青少年乳腺癌患者相关。近年来,环状RNA(circRNA)和微小RNA(miRNA)等非编码RNA的发现,在乳腺癌的无创诊断和预后评估中显示出良好的应用前景。乳腺癌患者血清或血浆中的miR-221,miR-21和miR-145在癌症的各个阶段均显示出比CEA和CA15-3更高的诊断敏感性。Iorio等人在2005年确定了乳腺癌患者中失调的miRNAs(mir-125b,mir-145,mir-21和mir-155),此外,Blenkiron等人在2007年在人乳腺组织和乳腺肿瘤组织中发现了133种miRNA。大约1/8的人类基因组被转录成circRNAs,由于环状结构和不具有3'、5'末端,这些circRNAs在各种体液中最稳定。Lu等人报道,在乳腺癌患者中,hsa circ103110,hsa circ104689和hsa circ104821分别上调[AUC值分别为0.63(0.52-0.74),0.61(0.50-0.73),0.60(0.49-0.71)]和hsa circ006054,hsa circ100219和hsa circ406697下调[AUC值分别为0.71(0.61-0.81),0.78(0.69-0.88),0.64(0.52-0.75)]。根据已发表的文献,所有这些组学生物标志物都具有临床潜力,需要进一步探索其临床价值。
四、展望未来
大量数据表明,每位乳腺癌患者都有独特的遗传、转录和表观遗传特征,不同的研究利用遗传(突变)和基因组信息(基因表达)探索乳腺癌的异质性。例如,Ciriello等利用来自多项研究的拷贝数和突变状况数据,将LuminalA乳腺癌亚型分为不同组(即混合型、拷贝数变异、8号染色体相关、1q/16q)。乳腺癌的这种表型和分子异质性降低了疗效,从而降低了临床结局,对个体患者进行基因组分析可以探索其分子异质性,为个体化治疗提供依据。需要进一步改进下一代技术,包括进一步提高准确性、灵敏度和为每个患者提供低成本的可用性。尽管基于DNA、RNA、蛋白质和表观遗传学的诊断和治疗性生物标志物的发现将提高对乳腺癌的认识,但这些标志物在各大洲患者之间的不可重复性限制了它们的使用。提高对疾病的认识是预防乳腺癌最有效的方法,应在不同层面上开展有组织的乳腺癌知识宣传和筛查工作,每个女性都应该了解自己的乳房,并应该传授有关乳腺癌和自我筛查的知识,乳腺癌高危女性应采取额外预防措施,包括咨询和临床咨询。
编译节选自:《Biomed Res Int》. 2023; 2023: 9872034




